甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系。下列说法正确的是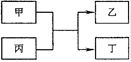
| A.若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物 |
| B.若甲为金属单质,乙为非金属单质,则甲只能是Mg |
| C.若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si |
| D.若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2 |
代表阿伏加德罗常数,下列说法正确的是()
| A. | 标准状况下, 中含有氯原子数目为 |
| B. | 中含有的氢原子数目为 |
| C. | 中含有的质子数目为10 |
| D. | 溶液中含有的 数目为0.5 |
下列家庭小实验中不涉及化学变化的是( )
| A. | 用熟苹果催熟青香蕉 | B. | 用少量食醋除去水壶中的水垢 |
| C. | 用糯米、酒曲和水制甜酒酿 | D. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐 |
下列事实与胶体性质无关的是()
| A.豆将里加入盐卤做豆腐 |
| B.河流入海处易形成沙洲 |
| C.一束平行光照射蛋白质溶液时,从侧面要看到光亮的通路 |
| D.在三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
由锌、铁、铝、镁四种金属的两种组成的混合物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混合物中一定含有的金属是()
| A.锌 | B.铁 | C.铝 | D.镁 |
下列溶液中,跟100mL 0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是()
| A.100mL 0.5mol/L MgCl2溶液 | B.200mL 0.25mol/L AlCl3溶液 |
| C.50ml 1mol/L NaCl溶液 | D.25ml 0.5mol/L HCl溶液 |