(15分)二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 。
(4)将合成气以n(H2)/n(CO)=2通入1L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
A.△H<0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。

(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
运用化学反应原理研究碳、氮、硫、氯等单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)下列措施中,不利于环境保护的有(填编号)。
a.大量开采使用化石燃料
b.使用无氟冰箱、空调
c.多步行多乘公交车,少用专车和私家车
d.将工业“废气”、“废液”、“废渣”直接排放
(2)工业上的“脱碳”指的是从“脱硝”、“脱硫”后的烟气用碱液吸收并得到浓缩的二氧化碳。利用二氧化碳合成甲醇是碳减排的新方向。
①写出吸收二氧化碳的离子方程式。
②常温下,0.1mol/LNaHCO3溶液的pH>8,则溶液中c(H2CO3) _______c(CO32-) (填“>”、“<”或“=”)。
③合成的甲醇可以做为新型燃料电池的原料,若电解液是碱性的,则其负极的电极反应式为。
(3)二氧化氯(ClO2),为一种黄绿色气体,是公认的高效、广谱安全的杀菌消毒剂。工业上制备ClO2的反应原理为:4HC1(浓)+2NaClO3=2ClO2↑+Cl2↑+2H2O+2NaCl。上述反应中,产生1 mol ClO2,则被氧化的HC1为。
(4)SO2溶于水可以得到二元弱酸H2SO3(亚硫酸)。
①25℃时,将NaOH深液与亚硫酸混合至恰好中和,则混合液中各种离子浓度的大小关系为。
②25℃时,当NaOH溶液与H2SO3等物质的量混合时,发现混合液pH<7,请你简要解释其原因。
化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是__________________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为_________、___________。
(3)某化肥厂用NH3制备NH4NO3,已知由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去NH3的质量占耗用全部NH3质量的__________%。
(4)合成氨气是生产氮肥的重要环节。合成氨生产简易流程示意图如下: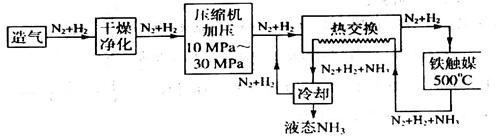
从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作___________。合成氨的反应需在500℃进行,其主要原因是_________。
某校化学小组的同学将一批废弃的线路板简单处理后,得到Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备强酸铜和硫酸铝晶体的方案:
回答下列问题:
(1)第②步加入H2O2是为了除云Fe2+,该反应的离子方程式为_________;
(2)滤渣2的主要成分是Fe(OH)3和Al(OH)3。由滤渣2制取Al2(SO4)3·18H2O实验过程的最后步骤是__________________。
(3)用第③步所得CuSO4·5H2O可制得Cu(OH)2。化学活动小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验过程:取0.98g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图所示,产物A、B的化学式分别为____和Cu2O。通过以上实验和图像可以得出如下结论:高温时B______(填“较稳定”或“不稳定”)。
活动小组同学还进行了如下实验:
①甲同学用下列装置进行实验(夹持装置末画出),最终得出的结论是加热时A可将NH3氧化为N2,A被还原为单质Cu,支持甲同学结论的现象是______;
②乙同学用下列实验装置进行实验,实验中观察到混合粉末最终变成红色物质,同时生成一种无色、有刺激性气味的气体,该气体化学式为_______;有人认为乙同学的实验装置中在装B物质的试管与烧杯之间需加一个防倒吸装置,你认为是否有必要_____,若有必要请简述原因并加以改进____________。
我国科研人员从天然姜属植物分离出的一种具有显著杀菌、消炎、解毒作用的化合物H。H的合成路线如下:
(1)A→B的反应类型是。
(2)化合物B中的含氧官能团为和(填官能团名称)。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式。
I.苯环上有两个取代基;II.分子中有6种不同化学环境的氢;III.既能与FeCl3溶液发生显色反应,又能发生银镜反应,水解产物之一也能发生银镜反应。
(4)实现F→G的转化中,加入的化合物X(C12H14O3)的结构简式为。
(5)化合物 是合成紫杉醇的关键化合物,请写出以
是合成紫杉醇的关键化合物,请写出以 为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
月桂烯( 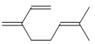 )是重要的化工原料,广泛用于香料行业。
)是重要的化工原料,广泛用于香料行业。
(1)月桂烯与足量氢气完全加成后生成A,A的名称是;
(2)以月桂烯为原料制取乙酸香叶酯的流程如下图: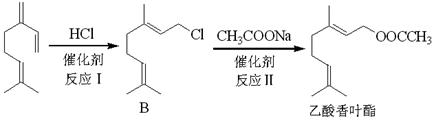
①B中官能团的名称;
②乙酸香叶酯的化学式;
③反应Ⅰ的反应类型是;
④反应Ⅱ的化学方程式是;
(3)已知:烯烃臭氧化还原水解反应生成羰基化合物,如: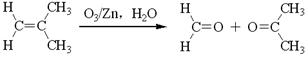
一定条件下,月桂烯可实现如下图所示转化(图中部分产物已略去):
①C与新制的Cu(OH)2悬浊液反应的化学方程式为:
;
②E在一定条件下能发生缩聚反应,写出其产物的结构简式。