【原创】据中国地震台网测定,3月30日在贵州省黔东南苗族侗族自治州发生5.5级地震,据了解,这已经是贵州这个月以来发生的第三次地震。饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,为防止灾后疫病使用了大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究。
(1)下面是某同学从超市购买的某品牌消毒液包装说明查询到的部分内容:主要有效成分为次氯酸钠,有效氯含量8 000~ 10 000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。本品须密封,置阴凉暗处保存。据此分析:
①室温时,他测得该消毒液(NaClO)的pH_______7(填“>”、“=”或“<”),其原因为(用离子方程式表示)_________________________。
②该消毒液还具有的化学性质有____(填序号)
| A.强氧化性 | B.强还原性 | C.不稳定性 | D.漂白性 |
③从该消毒液的保存要求分析,导致其失效的主要原因是(用化学方程式表示)_________________。
④日常生活中也常用明矾作净水剂,用离子方程式表示其净水原理___________________。
(2)该学习小组同学用石墨和饱和食盐水设计了如图所示的装置,进行消毒液( NaClO 溶液)制备,通电时,电解饱和食盐水的化学方程式为_________________;为使生成的Cl2完全被吸收,则电源的a极应为___极(填“正”或“负”),溶液中生成NaClO的离子方程式为____________________。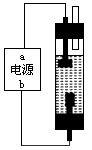
①~⑤五种元素在元素周期表中的位置如下图所示:回答下列问题: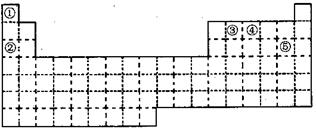
(1)①~⑤五种元素中,非金属性最强的元素在周期表中的位置是;
(2)②③④元素原子中,半径最小的是(填元素符号);
(3)元素①和③可以形成众成多的化合物,其中最简单的是(化学式)。该化合物中,化学键的类型为(选填“极性共价键”、 “非极性共价键”或“离子键”);
(4)元索④的最高价氧化物对应水化物能与其最低价的气态氢化物发生反应,产物是
(化学式);
(5)元素⑤单质与水反应的离子方程式:。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1) B元素的名称____,B在周期表中的位置第______周期,第________族;
(2) A、B形成的化合物的电子式____
(3) C的元素符号______,C的最高价氧化物的化学式____
(4) D的最高价氧化物对应的水化物的化学式____________
(1)元素最高正化合价为+6,其负化合价为____,某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为___________
(2)下列各题中有关物质的比较,请用“>”、“<”、“=”填空
酸性: H3PO4HNO3,H2SO4HClO4
热稳定性:CH4NH3,HClHI
(3)1-18号元素中,最外层电子数是次外层电子数二倍的元素是,原子结构示意图,能与氧形成的氧化物的化学式、。
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样,按下图所示进行实验: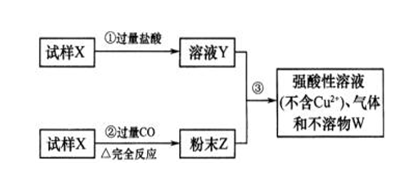
(1)写出步骤③中所发生反应的离子方程式。;
(2)若全部的溶液Y和全部的粉末Z充分反应,生成不溶性物W的质量为m ,则每份试样中氧化铜的质量为(用m表示)。
某学习小组用图中装置测定铝镁合金中铝的质量分数和铝的相对原子质量.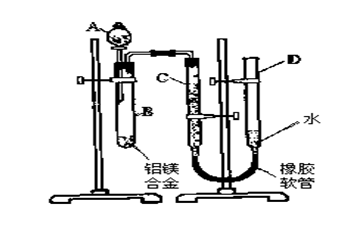
(1)A中试剂为.
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是.
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;上述操作的顺序是;(填序号)记录C的液面位置时,除视线平视外,还应.
(4)B中发生反应的化学方程式为 .
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b ml(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为.
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将.(填“偏大”、“偏小”、“不受影响”)