用CH4催化还原NOx可以消除氮氧化合物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法中错误的是
| A.等物质的量的CH4在反应①、②中转移电子数相同 |
| B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol |
| C.4NO2(g)+2N2(g)=8NO(g);△H=+586kJ/mol |
| D.若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6NA |
下列有关原子结构和元素周期律的表述正确的是()
①原子序数为15的元素的最高化合价为+3②ⅦA族元素是同周期中非金属性最强的元素③第二周期ⅣA族元素的原子核电荷数和中子数一定为6④原子序数为12的元素位于元素周期表的第三周期ⅡA族
| A.①② | B.①③ | C.②④ | D.③④ |
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量Na2SO4后进行电解,电解过程中产生的Cl2在弱碱条件下生成ClO-,把二价镍氧化成三价镍。以下说法正确的是( )
| A.可用铁作阳极材料 |
| B.电解过程中阳极附近溶液的pH升高 |
| C.阳极反应方程式为:2 Cl- + 2e- = Cl2 |
| D.2 mol二价镍全部转为三价镍时,外电路中通过了2 mol电子 |
如右图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾。则A与B可能是()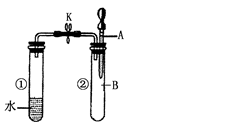
| A.水与氮气 |
| B.稀硫酸与一氧化碳 |
| C.饱和食盐水与氯气 |
| D.浓氢氧化钠溶液与二氧化碳 |
设NA为阿伏加德罗常数的值。下列说法正确的是( )
| A.常温常压下,16 g由O2和O3组成的混合气体所含电子数为8NA |
| B.实验室分别用KClO3和H2O2制取3.2g O2时,转移的的电子数均为0.4NA |
| C.25℃时,1 L pH=1的稀硫酸中约含2NA个H+ |
| D.标准状况下,22.4 L SO3所含分子数为NA |
下列说法或表示法正确的是( )
| A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后的终止温度 |
| B.由“C(石墨)=C(金刚石);△H=" +119" kJ/mol ”可知金刚石比石墨稳定 |
| C.在稀溶液中: H++OH-=H2O;△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ/mol |