【改编】常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.无色溶液中:K+、Fe3+、SO42-、H+ |
| C.c (H+)/c (OH-) = 1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.由水电离的c (H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
下列离子或分子在溶液中能大量共存,通入SO2后仍能大量共存的一组是
| A.K+、Ca2+、Br-、Cl- |
| B.NH3·H2O、SO32-、K+、Na+ |
| C.Fe2+、Na+、K+、NO3- |
| D.Na+、Mg2+、Cl-、ClO- |
实验是研究化学的基础,下列有关实验的方法、装置或操作都正确的是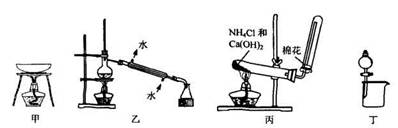
| A.从KI和I2的固体混合物中回收I2,可使用如图甲所示实验装置 |
| B.分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 |
| C.实验室制氨气,如图丙所示 |
| D.分离乙醇和乙酸的混合液,实验装置如图丁所示 |
由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如下,下列说法正确的是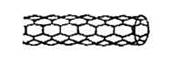
| A.纳米碳管是一种无机化合物 |
| B.纳米碳管中碳原子间以共价键结合 |
| C.纳米碳管与石墨互为同位素 |
| D.0.12g纳米碳管中含有6.02×l022个碳原子 |
在通常条件下,下列各组有机物的性质排列错误的是
| A.沸点:正戊烷>异戊烷 | B.密度:CH3CH2CH2Cl>CH3CH2Cl |
| C.熔点:CH3CH2CH2Cl>CH3CH2Cl | D.水溶性:CH3CH2OH>CH3CH2CH2CH2OH |
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体——黑磷,其转化过程如下:白磷  黑磷,黑磷比白磷稳定,结构与石墨相似。下列叙述正确的是
黑磷,黑磷比白磷稳定,结构与石墨相似。下列叙述正确的是
| A.白磷转化为黑磷是吸热反应 |
| B.黑磷与白磷互为同分异构体 |
| C.白磷转化为黑磷是氧化还原反应 |
| D.黑磷能导电 |