【原创】下列有关离子方程式或热化学方程式的说法正确的是
| A.Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+=2Fe3++3H2O |
B.一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)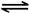 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| C.已知K sp(AgCl) >K sp(AgI),由此可以判断AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 |
| D.由H+(aq)+OH-(aq)=H20(1) △H="-57.3" kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ |
下列过程或现象与盐类水解无关的是
| A.纯碱溶液去油污 | B.铁在潮湿的环境下生锈 |
| C.加热氯化铁溶液颜色变深 | D.浓硫化钠溶液有臭味 |
pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
| A.9:1 | B.1:11 | C.1:9 | D.11:1 |
常温时,将pH为5的HCl溶液与pH为2的HCl溶液等体积混合后,溶液的氢氧根离子浓度最接近于( )
| A.2×10-12mol/L | B.1/2(10-9+10-12)mol/L |
| C.(10-9+10-12)mol/L | D.1/2(10-5+10-2) |
0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是()
| A.c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C.c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| D.c(Na+)=c(Cl-)>c(OH-)>c(H+) |
现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是()
| A.④>③>①=⑤>② | B.①=②>③>④>⑤ |
| C.②>①>③>④>⑤ | D.④>③>①>⑤>② |