(15分)发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6%(质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:2NH3(g) N2 (g) + 3H2(g) ΔH =" 92.4" kJ·mol-1
N2 (g) + 3H2(g) ΔH =" 92.4" kJ·mol-1
请回答下列问题:
(1)氨气自发分解的反应条件是 。
(2)已知:2H2 (g) + O2 (g) = 2H2O(g) ΔH = -483.6 kJ·mol-1
NH3(l)  NH3 (g) ΔH =" 23.4" kJ·mol-1
NH3 (g) ΔH =" 23.4" kJ·mol-1
则,反应 4NH3(l) + 3O2 (g) ="=" 2N2 (g) + 6H2O(g) 的 ΔH = 。
(3)研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
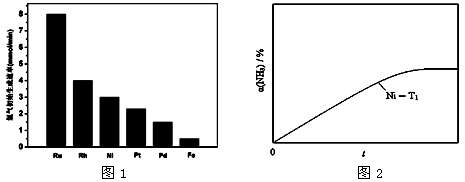
①不同催化剂存在下,氨气分解反应的活化能最大的是 (填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3)~t的总趋势曲线(标注Ru-T2)
④假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K = 。
(4)用Pt电极对液氨进行电解也可产生H2和N2。阴 极的电极反应式是 ;阳极的电极反应式是 。(已知:液氨中2NH3(l) NH2- + NH4+)
NH2- + NH4+)
已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列六种化合物:①NO ②N2O3 ③N2O4 ④HNO3 ⑤NH3 ⑥N2O中:
(1)氮元素只能作还原剂的是 (填序号,下同)。
(2)可能是HNO2还原产物的是 。
(3)不可能是N2的氧化产物的是 。
(4)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式
。
有反应:
①2H2O+Cl2+SO2====H2SO4+2HCl
②2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)两反应中的氧化剂的氧化性强弱顺序为 ,
还原剂的还原性强弱顺序为 。
(2)反应①中氧化产物和还原产物质量比为 。
一学生设计了如下实验方法分离NaCl、CaCl2两种固体混合物: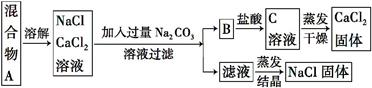
填空回答下列问题
(1)B是 (写化学式)。
(2)按此实验方案得到NaCl,经分析含有杂质,是因为上述方案中某一步设计有错误,这一步正确设计方案应是 。
(3)若要测定该样品中NaCl、CaCl2的质量比,可称量干燥的B和另一种物质的质量,这种物质是 。
(1)阅读、分析下列两个材料:
材料一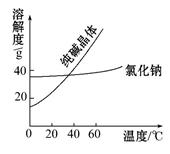
材料二
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| 乙二醇 |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
| 丙三醇 |
17.9 |
290 |
1.26 |
能跟水、酒精以任意比互溶 |
回答下列问题(填序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用 ;
②将乙二醇和丙三醇相互分离的最佳方法是 。
(2)阅读材料三。
材料三 在溶解性方面,Br2(溴)与I2很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
回答下列问题:
①常用的提取方法是 ,化学试剂是 ,最主要的仪器是 。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是 。
下图所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: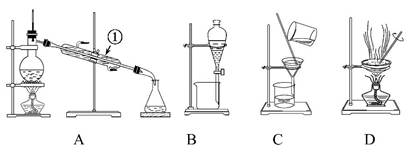
(1)从氯化钾溶液中得到氯化钾固体选择装置 (填代表装置图的字母,下同);除去自来水中的Cl-等杂质选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名称为 。
(3)装置A中①的名称是 ,进水的方向是 。装置B在分液时为使液体顺利滴下,应进行的具体操作是 。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
海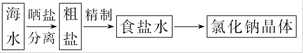
问题1:粗盐中含Ca2+、Mg2+、Fe3+、S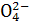 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是 (填写序号字母)。
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是 (填写序号字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
问题2:按所选顺序操作时,步骤④的化学方程式是
。
问题3:由海水到氯化钠晶体的实验过程中要用到的主要装置是 (从给定的四种装置中选择)。