若ABn的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥理论,判断下列说法中正确的是
| A.若n=2,则分子的立体结构为V形 |
| B.若n=3,则分子的立体结构为三角锥形 |
| C.若n=4,则分子的立体结构为正四面体形 |
| D.以上说法都不正确 |
甲、乙、丙、丁4种物质均为含有两种元素的化合物,其分子均含有18个电子,下列说法正确的是
| A.若气体甲的水溶液在常温下的pH<7,则甲一定是HCl |
| B.若气体乙的摩尔质量与O2相同,则乙一定是N2H4 |
| C.若3.0g丙的物质的量为0.1mol,则丙一定是甲烷的同系物 |
| D.若丁为四原子分子,则丁一定能使品红溶液褪色 |
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32- 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是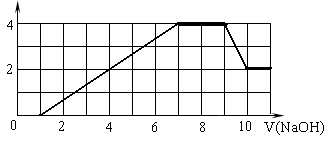
| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42— 和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1 |
| D.反应最后形成的溶液中含有的溶质为Na2SO4 |
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是
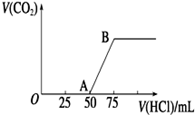
| A.OA段所发生反应的离子方程式:H++OH-==H2O;CO32- +H+ ==HCO3- |
| B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1 |
| C.产生的CO2体积(标准状况下)为0.056 L |
| D.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的Cl2恰好完全反应,则Cl2 的体积在标准状况下为
| A.7.84L | B.6.72L | C.4.48L | D.无法计算 |
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO)
| A.0.448 L | B.0.672 L | C.0.896 L | D.0.224 L |