氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
在一定温度下,反应A2(g)+B2(g)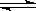 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
| A.单位时间生成 n 摩尔的A2同时生成 n 摩尔的AB |
| B.容器内的总压不随时间变化 |
| C.单位时间生成 2n 摩尔的AB同时生成 n 摩尔的B2 |
| D.单位时间生成 n 摩尔的A2同时生成 n 摩尔的B2 |
有一种气体在标准状况下体积是4.48升,质量是14.2g,则该气体的摩尔质量是
| A.28.4 | B.28.4g·mol-1 | C.71 | D.71g·mol-1 |
某学生做完实验以后,采用以下方法分别清洗所用仪器:
(1)用稀硝酸清洗做过银镜反应的试管;
(2)用酒精清洗做过碘升华的烧杯;
(3)用浓盐酸清洗做过高锰酸钾分解实验的试管;
(4)用盐酸清洗长期存放过三氯化铁溶液的试剂瓶;
(5)用氢氧化钠溶液清洗盛过苯酚的试管。你认为他的操作:
| A.(2)不对 | B.(3)、(4)不对 | C.(4)、(5)不对 | D.全部正确 |
下列物质中按照纯净物,混合物,电解质和非电解质的顺序排列的是
| A.盐酸,水煤气,醋酸,干冰 | B.冰醋酸,盐酸,硫酸钠,乙醇 |
| C.苛性钠,石灰石,铁,硫酸钡 | D.胆矾,漂白粉,氯化钾,氯气 |
某有机物的结构简式为CH2=C(CH3)—COOH,它不能发生的反应的是()。
| A.加成反应 | B.聚合反应 | C.酯化反应 | D.银镜反应 |