根据下列实验现象,所得结论正确的是
| 实验 |
实验现象 |
结论 |
| A |
左边烧杯中镁表面有气泡,右边烧杯中铜表面有气泡 |
还原性:Al>Mg>Cu |
| B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
| C |
试管中白色固体先变淡黄色,后变为黄色 |
沉淀转化的实质就是沉淀溶解平衡的移动 |
| D |
锥形瓶中有气体产生,烧杯中溶液变浑浊 |
非金属性:Cl>C>Si |
氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是()
| A.0.1mol/L该酸溶液的pH约为3 |
| B.HCN水溶液中, c(H+)> c(OH-) |
| C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D.HCN易溶于水 |
下列说法正确的是()
| A.自发反应都是熵增大的反应 | B.升高温度可以抑制盐类的水解 |
| C.凡是放热反应都是自发的 | D.盐类的水解是吸热反应 |
已知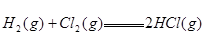 ;
;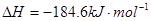 ,则反应
,则反应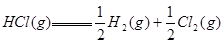 的△H为( )
的△H为( )
| A.+184 KJ/mol | B.-92.3 KJ/mol | C.-369 KJ/mol | D.+92.3 KJ/mol |
下列说法正确的是()
| A.用湿润的PH试纸可测溶液的酸碱性 | B.用碱式滴定管可量取5.00mLKMnO4溶液 |
| C.碳酸钠溶液可盛放于玻璃瓶塞的试剂瓶内 | D.氯水可用棕色试剂瓶保存于阴暗处 |
常温下,若10体积盐酸恰好与1体积pH=12的氢氧化钡溶液完全反应,则二者物质的量浓度之比应为()
| A.1 :5 | B.5 :1 | C.10 :1 | D.1 :10 |