欲降低废水中重金属元素铬的毒性,可将Cr2O 转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如下表。
| |
开始沉淀的pH |
完全沉淀的pH |
| Fe(OH)2 |
7.0 |
9.0 |
| Fe(OH)3 |
1.9 |
3.2 |
| Cr(OH)3 |
6.0 |
8.0 |
某含铬废水处理的主要流程如下图所示: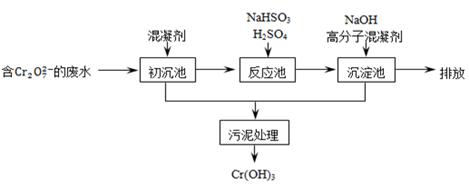
(1)Cr在周期表中的位置为 。
(2)初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示) 。
(3)请补充并配平以下反应池中发生主要反应的离子方程式:
____Cr2O72-+ ____HSO3-+ _______ = ____Cr3+ + ___SO42-+ ____H2O。
(4)根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH- = H2O和____________________。证明Cr3+沉淀完全的方法是______________________。
选择适当的试剂,除去以下物质中的杂质:
(1)苯中的甲苯;
(2)乙醇中的水;
(3)乙酸乙酯中的乙酸。
四苯基乙烯是一种在建筑及医疗设备、包装和电器制造中使用的化合物,结构如图。它的一氯代物有种,分子中能共面的碳原子最多有个。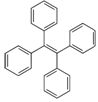
写出下列反应的化学方程式:
(1)乙烯与水反应:。
(2)把浓溴水滴入苯酚溶液中:。
(3)溴乙烷与NaOH的乙醇溶液共热:。
(4)CH2=CHCOOCH2CH3的聚合反应:。
请按要求回答下列问题:
(1)非诺洛芬是治疗类风湿性关节炎的药物,其结构简式为 。它的含氧官能团名称为,能发生的有机反应类型有。
。它的含氧官能团名称为,能发生的有机反应类型有。
(2)4-甲基-2-戊烯的结构简式为。
下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
① |
⑥ |
② |
|||||
| 3 |
③ |
④ |
⑤ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)画出①的原子结构示意图:, ⑩的元素名称:
(2)③④⑤原子半径由大到小的顺序是(填元素符号)
(3)表中最活泼的金属是,非金属性最强的元素是;(填写元素符号)
(4)表中能形成两性氢氧化物的元素是,写出该元素的氢氧化物与⑨的最高价氧化物对应水化物反应的离子方程式:。
(5)用电子式表示③与⑥的化合物的形成过程:。