(13分)重铬酸钾是一种重要的氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3、SiO2、Al2O3)为原料生产。实验室模拟工业法用铬铁矿制重铬酸钾(K2Cr2O7)的主要工艺如下: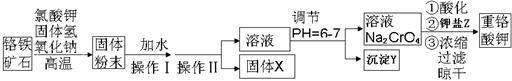
试回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有 。铁在周期表的位置是 。
(2)操作Ⅱ的名称是 。
(3)固体X的主要成分是___________,沉淀Y的主要成分是 。
(4)流程中①酸化所用的酸和②钾盐Z最合适的是(填符号)________,
| A.盐酸和氯化钾 | B.硫酸和氯化钾 |
| C.硫酸和硫酸钾 | D.次氯酸和次氯酸钾 |
酸化反应的离子方程式为 。
(5)FeO·Cr2O3与氯酸钾、氢氧化钠高温反应化学方程式: 。
I、“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验。因其具有许多优点,已被广泛应用于化学实验中。下图甲是对课本有关Na2O2某性质的两个实验的改进。
(1)将胶头滴管中的水滴入小试管,然后在导管口A、B处分别进行适当操作,再根据所观察现象可得到的两个结论是,。
(2)写出甲中反应的离子方程式。
Ⅱ、Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
步骤1:按图乙组装仪器(图中夹持仪器省略),检查气密性,装入药品;
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①盛装稀盐酸的仪器名称;B装置的作用是。
②必须检验氢气纯度的原因是。③设置装置D的目的是。
④你得到的结论是(若能反应请用化学方程式表示)。
氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置。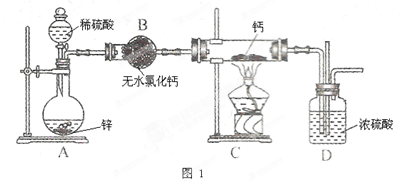
(1)装置B的作用是;
写出装置A中发生的反应的离子方程式。
试用双线桥分析氢化钙与水的反应。
(2)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,(请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间②收集气体并检验其纯度
③关闭分液漏斗活塞④停止加热,充分冷却
(3)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度。请完善下列实验步骤。 ①样品称量②加入__ ______溶液(填化学式),搅拌、过滤③________(填操作名称) ④_______(填操作名称)⑤称量碳酸钙的质量
为了探究HClO的漂白性,某同学设计了如下的实验。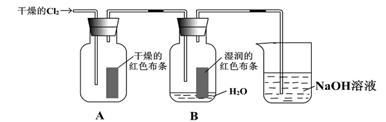
(1)写出C12与水反应的化学方程式________________________
(2)通入C12后,集气瓶A中的现象是__________________,集气瓶B中的现象是_______________,可得出的结论是___________________________。烧杯中的NAOH溶液的作用是,其反生反应的离子方程式为
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: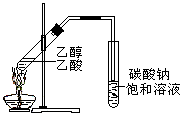
(1)写出制取乙酸乙酯的化学反应方程式,并指出其反应类型:_____ ,属于_______________反应。
(2)浓硫酸的作用是:①_________________________;②____________________。
(3)装置中通蒸气的导管要插在_____________溶液的液面上,不能插入溶液中,目的是防止_______ 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是___________。
A.蒸馏 B.分液 C.过滤 D.结晶
(5)用30克乙酸与46克乙醇反应,如果实际产率是理论产率的67%,则可得到乙酸乙酯的质量是______________。
A.29.5克 B.44克 C.74.8克 D.88克
关于卤化银分解实验的设计
有关卤化银的感光性,可按以下方法来进行实验:
试剂和仪器: 0.1 mol·L-1的NaCl、NaBr、KI溶液,2%的AgNO3溶液。500 mL圆底烧瓶、大烧杯、聚光电筒。
实验步骤:
(1)将3只预先注有4/5容积蒸馏水的圆底烧瓶用大烧杯垫托安置于讲台上,使之处于较好的视觉高度,编号。
(2)依次往上述烧瓶中加入2至5 mL NaCl、NaBr和KI溶液,振荡摇匀。
(3)慢慢地往烧瓶中滴加AgNO3溶液,边滴边振荡,可三名同学同时操作,3种胶体同时制作,便于比较。注意观察胶体形成的效果,要求胶体颜色明显,无浑浊状态。
(4)胶体制备好后,记录时间,用聚光电筒进行爆光(或置于阳光下),观察分解反应的速度及颜色等现象的变化,做好记录。
结论:分解速率:在同样光照条件下,AgBr分解最快,先由浅黄色透明状变成灰黑色浑浊态,时间约2 min;AgCl次之,由乳白透明状变成灰白浑浊态;AgI最慢,较长时间才略有变化。
问题:
1.你认为本实验有何优点?
2.18世纪70年代.瑞典化学家舍勒在研究一种白色、难溶于水的盐时发现,在黑暗中此盐并无气味,而在光照时开始变黑并有刺激性气味的气体产生。此盐是
A.氟化银 A.氯化银 C.溴化银 D.碘化银