【化学一一选修物质结构与性质】(15分)有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物, D与B可形成离子化合物其晶胞结构如图所示。请回答下列问题。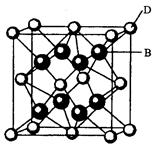
(1)E元素原子基态时的价电子排布式为 ;
(2)A2F分子中F原子的杂化类型是 _____;
(3)C元素与氧形成的离子CO2-的立体构型是__________;写出一种与CO2-互为等电子体的分子的分子式________;
(4)将E单质的粉末加入CA3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,该反应的离子方程式是______________________________________________________;
(5)从图中可以看出,D跟B形成的离子化合物的化学式为 ;若离子化合物晶体的密度为ag·cm-3,则晶胞的体积是 (写出表达式即可)。
【化学—选修3:物质结构与性质】
X、Y、Z、L四种元素分别位于周期表中三个紧相邻的周期且原子序数依次增大,它们相关信息如下:X元素原子的价电子构型为nsnnp2n,Y和Z位于同一周期,最外层都有两个未成对电子,L元素原子的基态未成对电子数是同周期最多的元素。
请回答如下问题:
(1)L元素在周期表中的位置是_______________,该原子核外电子排布式是_______________,其最高正价氧化物对应的水氧化物的化学式是_______________;
(2)元素X与Y形成的化合物晶体类型是晶体_________,1mol该化合物含有的化学键数为___________(用阿伏加德罗常数NA表示);
(3)元素M是周期表中电负性最强的元素,X与M形成的化合物XM2的分子几何构型是________,该化合物中X的原子的杂化轨道类型是____________;
(4)X与碳、氢、三种元素形成的相对分子质量最小的分子里有个____δ键,____个π键;
(5)金属元素N与Z形成的离子化合物的晶胞结构如图,晶胞中Z离子数目为______。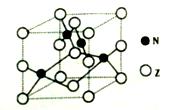
【化学—选修2:化学与技术】
海洋是一个丰富的资源宝库。通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩.所建盐田分为贮水池、______池和结晶池。
②工业上通常以NaCl、CO2和 NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式________。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图1所示.其中具有选择性的阴离子交换膜和阳离子交换膜相间排列.请回答下面的问题: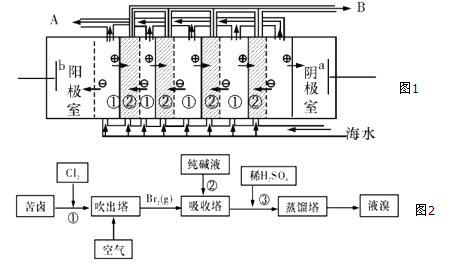
Ⅰ.电渗析法淡化海水中阴极室可获得的重要化工原料有________。
II.图中虚线部分表示____离子交换膜;淡水从_____(A或B) 排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如图(2):
Ⅰ.写出反应③的离子方程式为_____________________________;
II.通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?___________;
Ⅲ.向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是___________;
CO2和CH4是两种重要的温窒气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向。
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1="a" kJ•mol-1
CO(g)+H2O (g)=CO2(g)+H2(g)△H2="b" kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3="c" kJ•mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=_________;
2CO(g)+2H2(g) 的△H=_________;
(2)在一密闭容器中通入物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生上述反应,测得CH4的平衡转化率与温度及压强的关系如下图。
①判断该反应的△H________0(填“>”“<”或“=”)
②压强P1、P2、P3、P4由大到小的顺序为________________
③1100℃该反应的平衡常数为_________(保留小数点后一位)
④在不改变反应物用量的前提下,采取合理措施将Y点平衡体系转化为X点,在转化过程中,下列变化正确的是________(填序号)
a.v(正)一直增大 b.v(逆)一直增大
c.v(正)先减小后增大 d.v(逆)先减小后增大
(3)以Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸。
①该反应的化学方程式为____________________
②将Cu2Al2O4溶解在稀硝酸中的化学方程式为____________________
(4)以CO2为原料可以合成多种物质。
①利用FeO吸收CO2的化学方程式为:6 FeO+CO2=2Fe3O4+C,则反应中每生成1 mol Fe3O4,转移电子的物质的量为_______mol。
②以氢氧化钾水溶液作电解质进行电解,在铜电极上CO2可转化为CH4,另一电极石墨连接电源的_____极,则该电解反应的总化学方程式为____________________。
在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知Cu2+、Fe2+在pH=4~5时不水解,而Fe3+几乎完全水解而沉淀。
(1)加入氧化剂的目的_______________;
(2)下列物质都可以作为氧化剂,其中最适合本实验的是_____;
| A.H2O2 | B.KMnO4 | C.NaClO | D.K2Cr2O7 |
(3)物质Y是_________,加入Y的目的______________,沉淀E是_______________;
(4)欲将CuCl2•2H2O加热制得无水CuCl2,要采用什么方法和措施?_______________________
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈______(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)_____c(CH3COO-)(填“>”“<”或“=”,下同)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(Na+)_____c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈______,醋酸体积______氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则原醋酸溶液中c(H+)______氢氧化钠溶液中c(OH-),m与n的大小关系是m______n。