甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇:
CO (g)+2H2 (g) CH3OH (g)
CH3OH (g)
(1)在容积固定为2 L的密闭容器内充入1 mol CO和2 mol H2,加入 催化剂后在250 ℃开始反应,
CO的平衡转化率与温度、压强的关系如图所示。容器中M、N两点气体的物质的量之比为 。M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。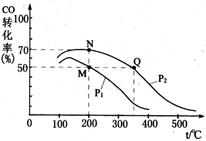
(2)通过压力计监测上述容器内压强的变化如下:
| 反应时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
| 压强/Mpa |
12.6 |
10.8 |
9.5 |
8.7 |
8.4 |
8.4 |
则从反应开始到20min时,以CO表示的平均反应速率为 ,该温度下平衡常数K= 。
(3)下列描述中能说明上述反应已达平衡状态的是 。
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(4)25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源电解300 mL NaCl溶液,正极反应式为 。在电解一段时间后,NaCl溶液的pH变为13(假设NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为__________。
维生素C的结构简式如图所示: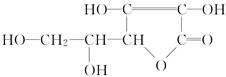
(1)维生素C的分子式为:______________。
(2)写出分子中官能团的结构简式和名称。、、。
(5分)有以下各组物质,完成以下各组问题:
| A.氧气与臭氧 |
| B.氕与氘 |
C.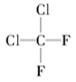 与 与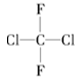 |
| D.乙烯与1—丁烯 |
E.己烷与2,3—二甲基丁烷
以上各组物质属于同位素的是________;属于同素异形体的是________;属于同系物的是________;属于同分异构体的是________;属于同一物质的是________。
下表为元素周期表的一部分,参照元素①~⑨在表中的位置,按要求回答下列问题: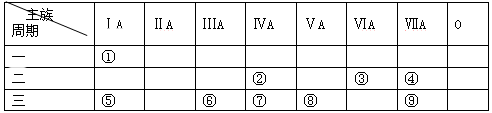
(1)在标号元素中,最活泼的金属元素名称是最活泼的非金属元素名称是。
⑨元素的原子结构简示意图(2分)。
(2)用电子式表示 ①与②形成共价化合物的形成过程(2分)。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是(序号表示,2分)。
(4)①~⑨元素所形成的气态氢化物中,最稳定的是(化学式表示,2分)
⑦、⑧、⑨三种元素的气态氢化物的稳定由强到弱的顺序 (化学式表示,2分)。
(5)写出元素⑨的单质与溴化钠反应的离子方程式:(2分)。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A为,B为,C为,D为。(填写相应的元素符号)
(2)写出A、B的化合物与E反应的化学方程式:。
(3)C元素的最高价氧化物的水化物与铝的氧化物对应的水化物反应的方程式 。
(4)写出D元素的最高价氧化物的水化物浓溶液和A反应的化学方程式:。
填空题 (每空2分,共 18 分)
(1)回答下列变化是哪些能量形式间的转化:
A用蓄电池点亮灯泡B植物的光合作用,C高温分解碳酸钙
(2)书写下列物质电子式 Na2O2
(3)用电子式表示下列物质的形成过程
CaCl2
(4)根据同主族元素性质的相似性和递变性进行预测:(各2分)
①酸性强弱:H3AsO4 H3PO4(用“>”或“<”表示,下同)
②沸点:HFHCl
(5)推测原子序数为34的元素硒(Se)处于元素周期表中族,关于Se的预测正确的是
| A.常温下Se单质是气体 |
| B.Se最高价氧化物的水化物能和NaOH发生反应 |
| C.氢化物的化学式为H2Se |
| D.常见的氧化物只有SeO3 |