将废旧锌锰电池处理得到含锰混合物,现以含锰混合物为原料制备锰锌铁氧体的主要流程如图l所示: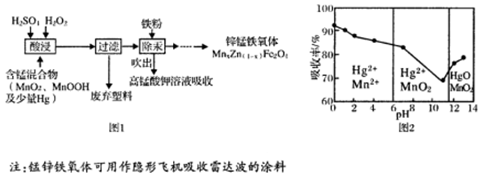
请回答下列问题:
(1)MnOOH中,锰元素的化合价为____。
(2)碱性锌锰干电池的电解质为KOH,Mn02参与的电板反应方程式为 。
(3)酸浸时,MnO2与H2SO4、H2O2反应的离子方程式为 。
(4)在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如图2所示:
①pH对Hg吸收率的影响规律是 。
②在强酸性环境下Hg的吸收率高的原因可能是 。
(5)锰回收新方法:向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnOOH+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O
①当1molMnO2参加反应时,共有_____mol电子发生转移。
②MnOOH与浓盐酸在加热条件下也可发生反应,试写出其反应的化学方程式:_________________。
③已知:Ksp(MnCO3)=2.3×10-11、Ksp(Mn(OH)2))=2.1×10-13,欲制备MnCO3,选用的加料方式是______(填字母),原因是___________________________________。
a.将MnSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将MnSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中
d.以上三种方法都无法制得MnCO3
2molSO3和3molSO2其分子数之比为_________;相同状况下(均为气体)体积之比为___________;氧原子数之比为______________。0.2 mol Al2(SO4)3中含有Al3+___________ mol、SO42-__________ mol.
写出下列盐类水解的离子方程式,并指出其溶液的酸碱性。
(1)硫酸铝溶液: (显 性)。
(2)硝酸铵溶液: (显_ 性)。
(3)次氯酸钠溶液: (显_ 性)。
(4)碳酸氢钠溶液: (显_ 性)。
某同学做如下实验,以检验反应中的能量变化。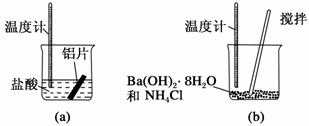
(1)实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是__________热反应;(b)中温度降低,由此可以判断(b)中反应是__________热反应。
(2)根据能量守恒定律,(b)中反应物的总能量应该__________其生成物的总能量。
已知Zn和Fe2O3在高温下发生反应:3Zn + Fe2O3 =" 2Fe" + 3ZnO,其中Zn是____________剂,被_______________,发生__________反应。氧化产物是_______还原产物是 ________。
1.5 mol O2的质量为_____________ g,标况下体积为_________ L。0.5mol H2O中含电子数为_________________mol