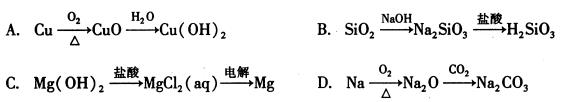经测定某溶液中离子只有Na+、Ac—、H+、OH—四种,且离子浓度大小的排列顺序为:c(Ac—)>c(Na+)>c(H+)>c(OH—),则不可能的情形是
| A.由pH=3的HAc与pH=11的NaOH溶液等体积混合而成 |
| B.由0.2 mol/L HAc溶液与0.1 mol/L NaOH溶液等体积混合而成 |
| C.由0.1 mol/L HAc溶液与等物质的量浓度等体积的NaOH溶液混合而成 |
| D.向上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为: c(Ac—) > c(Na+) > c(OH—) > c(H+) |
下列图示与对应的叙述相符的是
| A.图甲表示催化剂能改变化学反应的焓变 |
| B.图乙表示向氨水中加水时溶液导电性的变化情况,且溶液c(OH—)大小:a<b |
C.由图丙可知反应2A(g)+B(g)  C(g)的△H >O,且 a=2 C(g)的△H >O,且 a=2 |
| D.图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化情况 |
一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是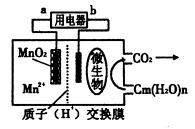
| A.电池工作时,电子由a流向b |
| B.微生物所在电极区放电时发生还原反应 |
| C.放电过程中,H+从正极区移向负极区 |
| D.正极反应式为:MnO2+4H+ +2e— ===Mn2+ +2 H2O |
下列相关工业制法的描述不正确的是
| A.电解熔融氯化钠制取金属钠 |
| B.电解熔融的Al(OH) 3制取金属铝 |
| C.用石英、纯碱、石灰石为原料制玻璃 |
| D.用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 |
利用下列图示进行相应实验,能达到目的的是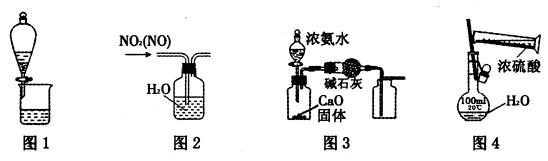
| A.用图1可萃取碘水中的碘 |
| B.用图2可除去NO2中的NO |
| C.用图3制取并收集干燥纯净的NH3 |
| D.用图4配制100mL一定物质的量浓度的稀硫酸 |
下列物质间的转化在给定条件下能实现的是