下列叙述不正确的是
| A.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 |
| B.0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 |
| D.在NaHCO3溶液中:c(OH—)+c(CO32—)=c(H+)+c(H2CO3) |
过量的下列溶液与水杨酸( )反应能得到化学式为C7H5O3Na的是
)反应能得到化学式为C7H5O3Na的是
| A.NaHCO3溶液 | B.Na2CO3溶液 |
| C.NaOH溶液 | D.NaCl溶液 |
某有机物的结构简式为 ,它的含有醛基(—CHO)的芳香族化合物的同分异构体共有
,它的含有醛基(—CHO)的芳香族化合物的同分异构体共有
| A.3种 | B.4种 | C.5种 | D.6种 |
近年来,食品安全事故频繁发生,人们对食品添加剂的认识逐渐加深。Butylated Hydroxy Toluene(简称BHT)是一种常用的食品抗氧化剂,合成方法有如下两种:
下列说法正确的是
A. 能与Na2CO3溶液反应生成CO2 能与Na2CO3溶液反应生成CO2 |
B. 与BHT互为同系物 与BHT互为同系物 |
| C.BHT久置于空气中不会被氧化 |
| D.两种方法的反应类型都是加成反应 |
《斯德哥尔摩公约》禁用的12种持久性有机污染物之一是滴滴涕,其结构简式为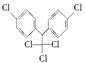 ,有关滴滴涕的说法正确的是
,有关滴滴涕的说法正确的是
| A.它属于芳香烃 |
| B.分子中最多有23个原子共面 |
| C.分子式为C14H8Cl5 |
| D.1 mol该物质最多能与5 mol H2加成 |
NA为阿伏加德罗常数,下列说法正确的是
| A.标准状况下,11.2 L的戊烷所含的分子数为0.5NA |
| B.28 g乙烯所含共用电子对数目为4NA |
| C.标准状况下,11.2 L二氯甲烷所含分子数为0.5NA |
| D.现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |