下列根据实验操作和现象所得出的结论,正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
某亚硫酸钠样品溶于水,加入氯化钡溶液,再加稀硝酸。 |
加入氯化钡溶液产生白色沉淀,加硝酸不溶。 |
该亚硫酸钠已变质 |
| B |
向Na2S溶液中滴加盐酸 |
产生臭鸡蛋气味的气体 |
氯的非金属性比硫强 |
| C |
将Zn粒加入pH相同的HA和HB两种酸溶液中, |
产生气泡的速率:HA﹥HB |
HA的酸性比HB强 |
| D |
CO还原Fe2O3得到的黑色固体加入盐酸溶解后,再加入KSCN溶液。 |
溶液不显红色 |
不能确定黑色固体中有无Fe3O4 |
可逆反应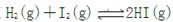 达到平衡状态时的标志是
达到平衡状态时的标志是
| A.混合气体的体积恒定不变 |
| B.混合气体的颜色不再改变 |
| C. H2、I2、HI的浓度相等 |
| D.I2、H2这两种气体在混合气体中的体积分数相等 |
对于反应A2+3B2=2C来说,以下化学反应速率的表示中,反应速率最快的是
A. v(B2)="0.8" mol/ (L·s) B. v(A2)="0.4" mol/ (L·s)
C. v(C)="0.6" mol/ (L·s) D. v(B2)=" 0.9" mol/ (L·s)
X、Y是元素周期表ⅦA族的两种元素,下列叙述中能说明X的非金属性比Y强的是
| A.X原子的电子层数比Y原子的电子层数多 |
| B.X的氢化物的沸点比Y的氢化物的沸点低 |
| C.X的气态氢化物比Y的气态氢化物稳定 |
| D.Y的单质能将X从NaX的溶液中置换出来 |
下列关于物质性质的比较,不正确的是
| A.金属性强弱:Na >Mg> Al | B.原子半径大小:Na> S >O |
| C.碱性强弱:KOH > NaOH > LiOH | D.酸性强弱:HIO4 >HBrO4> HClO4 |
下列说法正确的是
| A.若反应X + Y = M是放热反应,该反应一定不用加热。 |
| B.需要加热方能发生的反应一定是吸热反应。 |
| C.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应。 |
| D.反应物具有的总能量总是高于生成物所具有总能量 |