下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
| 选项 |
条件 |
离子组 |
离子共存判断及离子方程式 |
| A |
滴加氨水 |
Na+、Al3+、Cl—、NO3— |
不能大量共存,Al3++3OH—=Al(OH)3↓ |
| B |
由水电离出的c(H+) =1×10—13mol/L |
K+、NH4+、Cl—、AlO2— |
能大量共存 |
| C |
pH=1的溶液 |
Fe3+、NH4+、I—、SO42— |
不能大量共存, 2Fe3++2I—=2Fe2++I2 |
| D |
通入少量SO2气体 |
K+、Na+、ClO—、SO42— |
不能大量共存,2ClO—+ SO2+H2O=2HClO+SO32— |
下列化学用语正确的是 ( )
| A.1,2—二溴乙烷的结构简式:C2 H4 Br2 |
| B.羟基的化学式:OH- |
| C.己烷的分子式:C6H12 |
| D.乙烯分子的最简式:CH2 |
生活中常用一些化学知识,下列分析或结论正确的是 ( )
| A.“地沟油”经过加工处理制得肥皂或生物柴油,可以实现厨余废物合理利用 |
| B.淀粉、油脂和蛋白质都是高分子化合物,能发生水解反应 |
| C.液化石油气的主要成分是甲烷 |
| D.酿酒过程中,淀粉水解后即得乙醇 |
将0.8g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是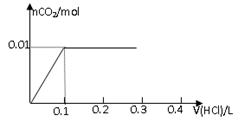

AB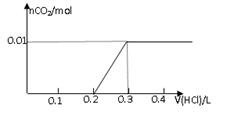
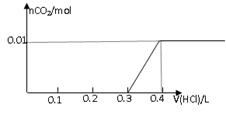
CD
下列选项中符合下图关系的是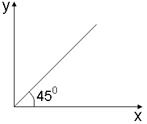
| A.烷烃中碳原子数(X)与氢原子数(Y)的关系 |
| B.温度大于100℃时,CH4和C2H4的混合气体在氧气中充分燃烧,同温同压下燃烧前后参与反应的气体的体积之和(X)与生成物的气体体积之和(Y)的关系 |
| C.二氧化硫与氧气在接触室中反应时,参加反应的氧气的物质的量(X)与生成的三氧化硫的物质的量(Y)之间的关系 |
| D.室温下硝酸钾溶于水达饱和时,消耗水的质量(X)与溶解的硝酸钾质量(Y)的关系 |
下列与有机物结构、性质相关的叙述错误的是
| A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 |
| B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 |
| D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |