(14分)工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素)。
请回答下列问题。
(1)装置Ⅱ中NO在酸性条件下生成NO2—的离子方程式 。
(2)含硫各微粒(H2SO3、HSO3—和SO32—)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。
①下列说法正确的是 (填标号)。
| A.pH=7时,溶液中c( Na+)<c (HSO-3) + c(SO2-3) |
| B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7 |
| C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜 |
| D.pH=2和 pH=9时的溶液中所含粒子种类不同 |
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4)已知进入装置Ⅳ的溶液中NO2—的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO2—完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
判断下列四句话的对错,并且说出理由:
(1)离子键只存在于离子化合物中
(2)离子化合物一定含离子键
(3)离子化合物中一定不存在分子
(4)离子化合物不一定含有金属元素
今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。
(1)试推断并写出甲、乙、丙、丁四种元素的名称和符号;
(2)写出几种上述元素两两化合形成的化合物的化学式。
连线题:将左栏与右栏相关的内容用直线连接。
①Hg2+ a.无菌无毒
②细菌b.水俣病
③镉c.痛痛病
④Fe2+ d.水体富营养化
⑤N和Pe.O3
氮氧化合物是大气污染的重要因素。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)=2NO(g)ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)=CO2(g)+N2(g) ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为(填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G  N2 + H2O + nX(未配平的反应式)。
N2 + H2O + nX(未配平的反应式)。
下列化合物中,满足上述反应式中的G是(填写字母)。
a.NH3 b.CO2 c.SO2 d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应的离子方程式为:。
②在酸性条件下,电化学降解NO3-的原理如下图,电源正极为:(选填“A”或“B”),阴极反应式为:。
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下: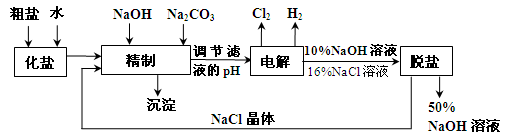
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为。
(3)精制过程要除去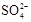 ,可选择下列溶液中的(填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
,可选择下列溶液中的(填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去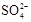 (已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:。
(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:。
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、、(填操作名称)而制得50%的NaOH溶液。