用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如图所示。下列说法正确的是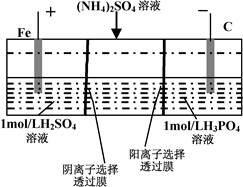
| A.阳极室溶液由无色变成棕黄色 |
| B.阴极的电极反应式为:4OH–-4e–=2H2O+O2↑ |
| C.电解一段时间后,阴极室溶液中的pH升高 |
| D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
如图是一种试验某气体化学性质的实验装置,图中B为开关。如果先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C中红色布条颜色褪去。则D瓶中盛有的溶液是( )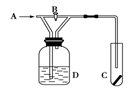
| A.饱和NaCl溶液 | B.浓H2SO4 | C.浓NaBr溶液 | D.浓NaOH溶液 |
下列说法中不正确的是()
| A.将NaOH溶液逐滴滴入到AlCl3溶液,先产生白色沉淀,最后沉淀消失 |
| B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出。 |
| C.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
| D.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 |
下列说法正确的是(设阿伏加德罗常数的数值为NA)()
| A.1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
| B.1mol/LK2SO4溶液所含K+数目为2NA |
| C.在标准状况下,22.4L水所含分子数目为NA |
| D.2.4gMg与足量盐酸完全反应时,失去电子数目为0.1NA |
某同学设计下列方法对A盐的水溶液进行鉴定: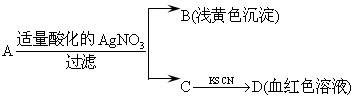
由此得出的结论中,不正确的是()
| A.滤液C中有Fe3+ |
| B.A一定为FeBr2 |
| C.D溶液中存在Fe(SCN)3 |
| D.B为AgBr |
下列变化中,需加入还原剂的是()
| A.2Cl- → Cl2 | B.Fe3+→Fe2+ |
| C.NH4+ → NH3 | D.HCO3- →CO2 |