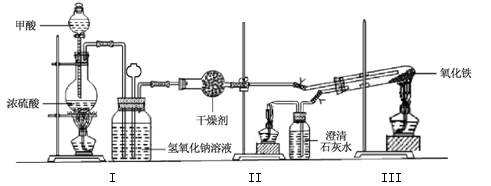
实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
|
|
①按上图连接好装置,检查装置气密性。
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。| 加热方式 |
产物元素组成 |
各元素的质量分数% |
|
| Fe |
O |
||
| 酒精灯 |
Fe和O |
74.50 |
25.50 |
| 带网罩酒精灯 |
Fe和O |
76.48 |
23.52 |
| 酒精喷灯 |
Fe |
100.00 |
0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____:1。(要求保留整数)
(15分)过硫酸钠( Na2S2O8)是一种重要化工原料。某研究小组进行如下实验
实验一过硫酸钠的制取
采用下图装置制取Na2S2O8。
装置I中:主反应:(NH4)2S2O8 +2NaOH Na2S2O8+2NH3↑+2H2o
Na2S2O8+2NH3↑+2H2o
副反应:①2NH3+3Na2S2O8十 6NaOH===6Na2SO4 +6H2o十N2
6NaOH===6Na2SO4 +6H2o十N2
②3Na2S2O8 +3H2O+3Na2SO4+3H2SO4 +O3 ↑
(1)装置Ⅱ的作用是。
(2)装置I还需补充的实验仪器或装置有_(填序号)。
a.温度计b.酒精灯 c.水浴 d.洗气瓶
(3)装置I发生反应的同时需要持续通入氮气的目的是
实验二过硫酸钠的性质实验
(4)为研究Na2S2O8溶解度随温度变化情况,实验过程需要测定的数据是 。
(5)Na2S2O8溶液与铜反应时先慢后快,除反应放热这一因素外,有人认为还有一种可能是反应生成的Cu2+对后续反应起催化作用,能检验该说法是否正确的实验方案为。
实验三过硫酸钠的应用研究
(6)为检验用Na2S2O8溶液吸收NO的可行性,某同学设计下图所示实验(已知NO不溶于NaOH溶液)。实验步骤如下:
i.检查装置气密性,并按下图加人试剂;
ii.打开a和d,通人足量N2,关闭d;
iii.往装置中通人适量NO,关闭a;
iv.....
①步骤iv中,对分液漏斗的操作是_。
②能证明该方案可行的实验现象是_。
亚氯酸钠(NaClO2 )是一种高效漂白剂和强氧化剂。某兴趣小组以NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如下:
回答下列问题:
(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧杯、玻璃棒、、。
(2)实验须使NaClO3稍微过量,目的是。
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意。
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2—,则另一种为。
(5)B中反应的离子方程式为。
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入(填序号,下同)酸化,再加入检验。
①稀HNO3②稀H2SO4③K2SO3溶液④BaCl2溶液⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9 g NaClO2·3H2O(式量:144.5),
至少需g NaClO3(式量:106.5)。
亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按下图装置进行制取。
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要(填仪器名称);
(2)装置C的作用是;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i.55℃蒸发结晶;
ii.趁热过滤;
iii.;
iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是;
a. B中有SO2气体产生,并有部分进入D装置内
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是;
②所称取的样品中NaClO2的物质的量为(用含c、V的代数式表示)。
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是。
| 第1组 |
第2组 |
第3组 |
| S(单质) |
SO2、X、Na2SO3、NaHSO3 |
SO3、H2SO4、Na2SO4、NaHSO4 |
(2)利用下图所示的装置研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO344.8℃)
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时溶液酸性增强,则该反应的离子方程式是。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是。
溴乙烷是一种重要的有机化工原料,其沸点为38.4 ℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应。
(1)该反应的化学方程式是_______________________________________。
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在实验室制备溴乙烷的装置如图,实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应。
已知反应物的用量:0.3 mol NaBr(s);0.25 mol乙醇(密度为0.80 g·mL-1);36 mL硫酸。
请回答下列问题。
(2)装置A的作用是________________________。
(3)反应时若温度过高,则有SO2生成,同时观察到还有一种红棕色气体产生。反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的____________(填写正确选项的字母)。
a.饱和食盐水 b.稀氢氧化钠溶液 c.乙醇d.四氯化碳
(4)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后________ (按实验的操作顺序选填下列序号)。
①加热②加入AgNO3溶液 ③加入稀硝酸酸化 ④加入NaOH溶液
(5)本实验的产率为80%,则可制取溴乙烷g。