选考[化学—选修2:化学与技术]工业合成氨技术是对人类的巨大贡献之一。下面是合成氨的简要流程示意图: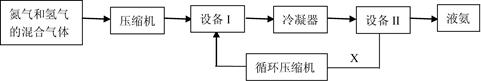
(1)设备I的名称是 ,沿X路线循环的物质是 (填字母)。
| A.N2和H2 | B.催化剂 | C.NH3 | D.N2、H2和NH3 |
(2)合成氨中H2可以由焦炭和水蒸汽反应获得。请写出该反应的化学方程式:_______。
(3)原料气中往往含有H2S、CO、CO2等杂质,必须除去这些杂质的目的是 ,常用K2CO3溶液除去CO2,其反应的离子方程式为 。
(4)近年有人将电磁场直接加在氮气和氢气反应的容器内,在较低的温度和压强条件下合成氨,获得了较高的产率。电磁场对合成氨反应本质的影响是_______,该方法的优点是_________________。
(5)合成氨工业往往含有大量含氨废水,为了防止对环境造成污染,可以利用电解法将NH3·H2O转化为对环境无污染的加以处理。电解时以石墨做电极,以硝酸作为电解质,则理论上处理1mol NH3·H2O,电路中转移电子 mol,阳极的电极反应式为 。
金属是一种重要的材料,人类的生产和生活离不开金属,下表表示了金属活动顺序表中铜、铁、锡、铝元素被人类大规模开发利用的大致年代。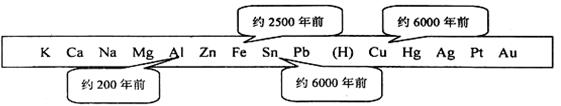
33. 根据图中数据和有关化学知识,你认为金属大规模开发利用的先后顺序跟______有关(填写编号)。
a. 金属的导热性 b. 金属元素在地壳中的含量
c. 金属的活动性顺序 d. 金属的延展性
34. 钢铁的生产和使用是人类文明和进步的重要标志之一,请用化学方程式表示高炉炼铁的原理___________________________________________。
35. 比较铝、铁的活泼性,可用一个实验事实说明:__________________________________;
但是铝在空气中却表现出很强的抗氧化性,其原因是____________________________。
36. 复方氢氧化铝可以治疗胃酸过多,也能与强碱溶液反应, 写出氢氧化铝的电离方程式___________________________________________________________。
合成氨反应(N2+3H2 2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
2NH3+92.4KJ)在化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。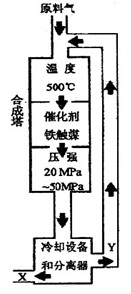
30. X的化学式为;X的状态为_______态。
31. 据右图分析,下列说法正确的是(填写编号)。
a.在此温度下,有利于平衡正向移动,可提高氨的产量
b.铁触媒的使用有利于平衡正向移动
c.工业生产受动力、材料、设备等条件的限制,选择此压强
d.为提高原料的转化率,采用循环操作
32. 常温下氨气极易溶于水,其水溶液可以导电。
① 氨水中水的离子积常数的数值是_______________________;
② 将相同体积、相同物质的量浓度的氨水和盐酸混合后,
溶液中离子浓度由大到小依次为。
电解饱和食盐水的反应为2NaCl+2H2O Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。
27. 在上述方程式上标出电子转移的方向和数目。
28. 该反应中被氧化的元素是。阴极产物之一为H2,阴极上发生的变化为反应(选填“氧化”、“还原”)。
29. 电解产物氯气既能作氧化剂,也能作还原剂。下列反应中氯气只作氧化剂的是(填写编号)。
a.Cl2+2KI→2KCl+I2 b.Cl2 + 2NaOH →NaCl + NaClO + H2O
c.CuCl2 Cl2↑+ Cud.3Cl2 + 2Fe
Cl2↑+ Cud.3Cl2 + 2Fe 2FeCl3
2FeCl3
下表是元素周期表的一部分,针对所给的元素,完成下列各小题。
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
| 2 |
C |
N |
O |
||||
| 3 |
Na |
Al |
Si |
S |
Cl |
21. 第3周期中金属性最强的元素是(填元素名称)。
22. C、N和O原子半径由小到大的顺序的是。
23. 第3周期中气态氢化物最稳定的是(填化学式)。
24. Si是带来人类文明的重要元素之一,其氧化物化学式是。
25. 铝是大自然赐予人类的宝物。它的一个用途是发生铝热反应,冶炼某些难熔金属,写出
该反应的一个化学方程式。
26. S元素形成的氢化物与其氧化物SO2相遇后的现象是。
(1)写出表示含有8个质子、10个中子、10个电子的离子的符号。(写成ZAXn-的形式)
(2)周期表中位于第8纵行的铁元素属于第族。
(3)周期表中最活泼的非金属元素位于第纵行族。