已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价与W元素最高正价绝对值相等;工业上常用电解熔融氧化物的方法冶炼W单质;Z、W、R最高价氧化物对应的水化物两两反应均生成盐和水。下列说法正确的是
| A.简单离子半径:Y>Z>W |
| B.简单氢化物的热稳定性:X>Y>R |
| C.W的最高价氧化物对应的水化物碱性比Z的强 |
| D.R的最高价氧化物对应的水化物化学式一定是HRO4 |
可逆反应a A(s)+b B(g) c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是
c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是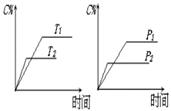
| A.达平衡后,加入催化剂则C%增大 |
| B.达平衡后,若升温,平衡左移 |
| C.化学方程式中b >c +d |
| D.达平衡后,增加A的量有利于平衡向右移动 |
强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 |
| C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列
叙述正确的是
(1)生成物的质量分数一定增大(2)生成物产量一定增加
(3)反应物的转化率一定增大(4)反应物的浓度一定降低
(5)正反应速率一定大于逆反应速率(6)一定使用催化剂。
| A.(1)(2)(3) | B.(3)(4)(5) | C.(2)(5) | D.(4)(6) |
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(KJ·mol–1)P–P:198 P–O:360 O=O:498 则反应P4(白磷,s)+ 3O2(g)==P4O6(s)的反应热△H为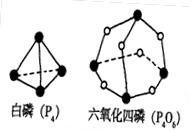
| A.+1638KJ·mol–1 | B.–1638KJ·mol–1 |
| C.+126KJ·mol–1 | D.–126KJ·mol–1 |
在密闭容器中,反应X2(g)+Y2(g)  2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是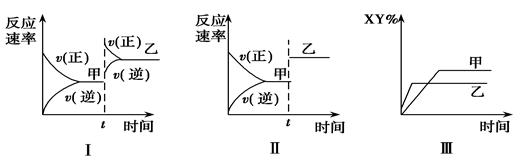
| A.图Ⅰ是增大压强的变化情况 |
| B.图Ⅱ一定是加入催化剂的变化情况 |
| C.图Ⅲ是增大压强或升高温度的变化情况 |
| D.图Ⅲ是升高温度的变化情况 |