【实验化学】硫酸锌是一种重要的工业原料。在实验室从粗锌(含有少量的铅)与稀硫酸反应后的废液中提取硫酸锌的主要操作步骤如下:
步骤1:将废液过滤,调节滤液的pH约为2,过滤,将滤液加热浓缩,制得较高温度下的饱和溶液,冷却结晶得到粗制晶体。
步骤2:①在烧杯中用蒸馏水溶解步骤1得到的晶体,滴加少量稀硫酸,水浴加热至晶体全部溶解。
②停止加热,让其自然冷却、结晶。
③抽滤,用少量无水乙醇洗涤晶体1~2次,得精制晶体。
(1)废液中含有的不溶性杂质是________。
(2)步骤1中调节滤液pH约为2,可加入的物质是________(填字母)。
a.NH3·H2O b.ZnO c.ZnCO3 d.NaOH
(3)步骤1中对滤液加热浓缩时,当________时,停止加热。
(4)步骤2中滴加少量稀硫酸的目的是____。
(5)抽滤装置如图所示,仪器B的名称是________。仪器C的作用是____________。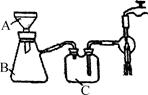
(6)用少量无水乙醇洗涤晶体的目的是________。
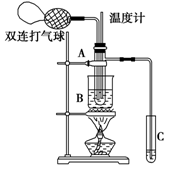
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、铜粉,试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时,用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全。有关物质的沸点如下:
| 物质 |
乙醛 |
乙酸 |
甘油 |
水 |
| 沸点/℃ |
20.8 |
117.9 |
290 |
100 |
请完成下列问题:
(1)试管A在60℃~80℃时发生的主要反应的化学方程式为(根据题意注明反应条件)
______________________________________________________________________。
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;当试管A内主要反应完成后,温度计水银球的位置应在_____________,目的是____________________________。
(3)烧杯B内盛装甘油,甘油浴的作用是:
_____________________________________,______________________________________。
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸,红色的石蕊试纸,白色的醋酸铅试纸,碳酸氢钠粉末。实验仪器任选。该方案为(简述操作过程):__________________________________________________
实验室用托盘天平等仪器配制500mL 1mol·L-1的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放人小烧杯中,加适量蒸馏水溶解;②把①所得溶液小心转人500mL容量瓶中;③继续向容量瓶中加蒸馏水至液面距离刻度l—2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀。
请填写下列空白:
(1)计算需要NaCl晶体 g。
(2)实验操作步骤的正确顺序为(填序号)
(3)使用容量瓶前必须进行的一步操作是 。
(4)配制过程中,其他操作都正确,下列操作会引起浓度偏高的是 。
①未洗涤烧杯、玻璃棒②容量瓶不干燥,含有少量蒸馏水③定容时俯视标线④定容时仰视标线⑤超过刻度线,吸出一部分水;⑥摇匀后液面下降,补充水。
(5)配制上述溶液需要用到的玻璃仪器是下图中的(填编号):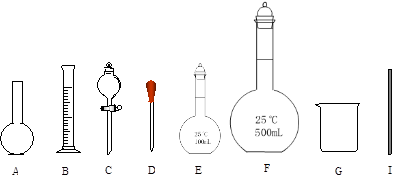
指出下面3个实验中各存在的一个错误: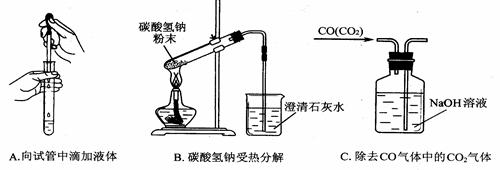
A___________________、B_____________________、C__________________
下面是某研究小组研究的关于不同催化剂对H2O2分解反应的催化效率。
| 催化剂(0.1g) |
活性炭 |
FeCl3 |
KI |
MnO2颗粒状 |
MnO2粉末状 |
| 前15s产生氧气的量(ml) |
5 |
11 |
7 |
8 |
11 |
| 前30s产生氧气的量(ml) |
8 |
16 |
11 |
11 |
21 |
| 前45s产生氧气的量(ml) |
11 |
20 |
15 |
18 |
35 |
| 前60s产生氧气的量(ml) |
15 |
24 |
20 |
26 |
49 |
(1)写出H2O2在催化剂作用下分解反应的化学方程式______________________________
(2)从上表可以得出:
活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是__________
等质量的固体催化剂,颗粒大小对催化效率有什么影响__________________________
(3)实验发现新鲜的动物肝脏对H2O2的分解也有显著的催化作用,但当往溶液中加入盐酸,或给溶液加热时,就会失去催化能力,合理的解释是
(4)对于FeCl3的催化作用,有人认为是Fe3+起催化作用,有人认为是Cl-,请你设计一个实验进行验证。
___________________________________________________________
⑴ 准确称取烧碱样品4.1g,将样品配成250mL的待测液,需要的仪器有托盘天平、小烧杯、量筒、玻璃棒、、。(填仪器)
⑵ 用(“碱式”或“酸式”)滴定管量取10.00mL待测液注入锥形瓶中。
⑶若锥形瓶用蒸馏水洗涤后,水未倒尽,则测得样品中烧碱的质量分数________(填“偏高”、“偏低”或“无影响”)。
⑷若滴定到达终点时,仰视读出滴定管读数;则测得样品中烧碱的质量分数________ (填“偏高”、“偏低”或“无影响”)。
⑸滴定时边滴边摇动锥形瓶,眼睛应观察______。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
⑹滴定达到终点时的现象。
⑺ 根据下列测定数据,分析得到合理数据,计算待测烧碱溶液的浓度:。
| 滴定次数 |
待测液体积/mL |
标准盐酸体积/mL |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
10.00 |
0.50 |
20.40 |
| 第二次 |
10.00 |
4.00 |
24.10 |
| 第三次 |
10.00 |
5.70 |
25.70 |
⑻ 已知标准盐酸的浓度为0.2010 mol·L-1,根据上述测定数据,分析得到合理数据,计算烧碱的纯度。