25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,不正确的是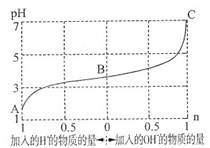
A.A、B、C三点所表示的溶液中水的电离程度依次增大
B.通入HCl,HA的电离常数减小,A-的水解程度增大
C.加入1 mol NaOH后,溶液中c(Na+)=c(A-)
D.未加HCl和NaOH时,溶液中c(A-)>c(Na+)>c(HA)
对原子核外电子以及电子的运动,下列描述正确的是( )
①可以测定某一时刻电子所处的位置②电子质量很小且带负电荷③运动的空间范围很小④高速运动⑤有固定的运动轨道⑥电子的质量约为氢原子质量的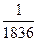
| A.①②③ | B.②③④⑥ |
| C.③④⑤⑥ | D.⑤⑥ |
下列粒子的结构示意图正确的是( )
欧洲核子研究中心于1995年9月10日研制成世界上第一批反原子——共9个反氢原子,揭开了人类制取、利用反物质的新篇章。请完成下列问题:
(1)反氢原子的结构示意图中,正确的是( )
(2)如果制取了反氧原子,则下列说法中,正确的是( )
A.核内有8个带正电的质子,核外有8个带负电的电子
B.核内有8个带负电的电子,核外有8个带正电的质子
C.核内有8个带负电的中子,核外有8个带正电的质子
D.核内有8个带负电的质子,核外有8个带正电的电子
(3)以下表示反物质酸碱中和反应的通式是( )
A.H++OH+ H2O B.H++OH+
H2O B.H++OH+ H2O
H2O
C.H-+OH- H2O D.H++OH-
H2O D.H++OH- H2O
H2O
有几种元素的粒子的结构示意图如下图所示,其中:
(1)某中性粒子一般不和其他元素的原子发生反应,这种粒子的符号______。
(2)某粒子的盐溶液,加入AgNO3溶液时会出现白色沉淀,这种粒子的符号是______。
(3)某粒子氧化性很弱,但得到1个电子后还原性很强,这种粒子的符号是______。
(4)某粒子具有很强的还原性,且这种粒子失去了2个电子即变为原子,这种粒子的符号是______。
某金属元素的一种同位素R的质量数为52,已知R离子含28个中子,21个电子,由这种离子组成的化合物的化学式正确的是( )
| A.RCl2 | B.R(OH)3 | C.RO2 | D.K2R2O7 |