少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改
变H2的产量,可以使用如下方法中的
①加H2O ②加CH3COONa固体 ③改用10 mL 0.1 mol·L-1盐酸
④滴入几滴硫酸铜溶液 ⑤升高温度(不考虑盐酸挥发)
| A.①② | B.②③ | C.③⑤ | D.④⑤ |
废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是
| A.锌 | B.汞 | C.石墨 | D.二氧化锰 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
将物质的量均为0.1 mol K2SO4和Al2(SO4)3溶于水,向其中加入一定量的Ba(OH)2溶液,测得铝元素有一半留在溶液中,则生成BaSO4的物质的量可能为
| A.0.15 mol | B.0.30 mol | C.0.35 mol | D.0.4 mol |
工业上通过2Al2O3+3C+6Cl2 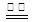 4AlCl3+3CO2制取无水氯化铝,下列说法正确的是
4AlCl3+3CO2制取无水氯化铝,下列说法正确的是
| A.AlCl3是氧化产物 | B.Cl2是氧化剂 |
| C.每生成1 mol CO2,转移4个电子 | D.C发生还原反应 |
下列装置应用于实验室制二氧化硫并验证其漂白性的实验,其中能达到实验目的的是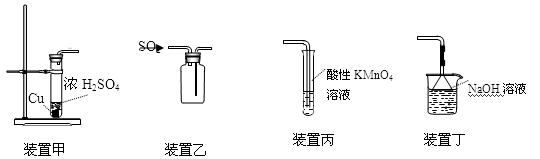
| A.用装置甲制取二氧化硫 |
| B.用装置乙收集二氧化硫 |
| C.用装置丙验证二氧化硫的漂白性 |
| D.用装置丁吸收二氧化硫 |