Ⅰ.(1)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式。
N2(g)+O2(g)==="2NO(g)" ΔH=+180 kJ·mol-1;
N2(g)+2O2(g)===2NO2(g) ΔH=+68 kJ·mol-1;
2C(s)+O2 (g)===2CO(g) ΔH=-221 kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
①一定条件下,N2与O2反应生成NO能够自发进行,其原因是___,NO分子中化学键的键能为___kJ·mol-1。
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)===4CO2(g)+N2(g) ΔH=________。
Ⅱ.熔融状态下,钠的单质和FeCl2能组成可充电电池(装置示意图如下),反应原理为:
2Na+FeCl2 Fe+2NaCl
Fe+2NaCl
放电时,电池的正极反应式为________________;充电时,________(写物质名称)电极接电源的负极;该电池的电解质为____ __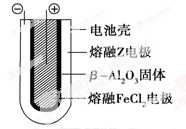
I.在反应:3Cu+□HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,请填写□中的数字是 。若有19.2 g铜被氧化,参加反应的HNO3的物质的量是___________mol,被还原的HNO3的物质的量是________mol,转移电子的数目为 。用单线桥标出该反应中电子转移的方向和数目:__________________
II.反应H2S+H2SO4(浓)=S↓+SO2↑+H2O中,氧化产物是 (填化学式)
反应6NO2+8NH3=7N2+12H2O中,氧化产物与还原产物的质量比是______________
有一固体混合物,可能由Na2CO3、Na2SO4、Fe2(SO4)3、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加过量的硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀部分溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是______________,一定不含有的物质是______________,可能含有的物质是______________。对可能含有的物质,可采用向滤液中滴加______________溶液的方法来检验。(以上空格均填写化学式)
(2)写出步骤③中的离子方程式:__________________________
(3)硫酸铁在水溶液中的电离方程式________________________
I.按要求写出对应反应的离子方程式:
(1)硫酸镁溶液与氢氧化钡溶液反应 ;
(2)用氢氧化钠溶液出去CO中少量的 CO2气 ;
(3)用稀硫酸除去铁钉上的铁锈(主要成分是Fe2O3) ;
II.以下8种为中学化学中常见的物质:
①CaO ②H2O ③胆矾 ④CaCO3 ⑤H2SO4 ⑥氨水 ⑦酒精 ⑧Cu
请按下列分类标准回答问题:
(1)属于电解质的是 (2)属于盐的是
(3)属于氧化物的是 (4)属于非电解质的是
现有25℃时0.1mol•L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,一水合氨的电离平衡___________移动(填“向左”、“向右”或“不”);此时溶液中C(OH-)/C(NH3·H2O)___________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸至溶液的pH=7,此时C(NH4+)="a" mol•L-1,则C(SO42-)=_______________。
(3)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:__________________;所得溶液的pH___________7(填“>”、“<”或“=”),用离子方程式表示其原因______________,所得溶液中各离子的物质的量浓度由大到小的顺是______________________。
甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
| 温度 |
250 ℃ |
300 ℃ |
350 ℃ |
| K |
2.0 |
0.27 |
0.012 |
(1)在一定条件下将2 mol CO和6 mol H2充入2 L的密闭容器中发生反应Ⅰ,5 min后测得c(CO)="0.4" mol/L,计算可得此段时间的反应速率(用H2表示)为 mol/(L·min)。
(2)由表中数据判断ΔH1 0(填“>”、“<”或“=”);反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH3= (用ΔH1和ΔH2表示)。
CO(g)+H2O(g) ΔH3= (用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号)。
A.充入CO,使体系总压强增大 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大D.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ= ;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡 移动(填“正向”、“逆向”或“不”),平衡常数KⅡ (填“变大”、“变小”或“不变”)。