下列关于离子键的特征的叙述中,正确的是
| A.一种离子对带异性电荷离子的吸引作用与其所处的方向无关,故离子键无方向性 |
| B.因为离子键无方向性,故阴、阳离子的排列是没有规律的、随意的 |
| C.因为氯化钠的化学式是NaCl,故每个Na+周围吸引一个Cl- |
| D.因为离子键无饱和性,故一种离子周围可以吸引任意多个带异性电荷的离子 |
用四氯化碳萃取碘的饱和水溶液中的碘,下列说法中不正确的是
| A.实验使用的主要仪器是分液漏斗 |
| B.碘在四氯化碳中的溶解度比在水中的溶解度大 |
| C.碘的四氯化碳溶液呈紫红色 |
| D.分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出 |
实验中需1mol/L的CuSO4溶液950mL,配制时应选用的容量瓶的规格和称取的胆矾的质量分别是
| A.950mL,152g | B.950mL, 237.5g |
| C.1000mL,250g | D.1000mL,160g |
下列有关化学物质的俗称错误的是
| A.碳酸钠的俗称是纯碱 | B.四氧化三铁的俗称是磁性氧化铁 |
| C.氧化铁的俗称是铁红 | D.碳酸氢钠的俗称是苏打 |
25℃时,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后溶液体积为混合前两溶液的体积之和)。下列叙述错误的是
| A.混合溶液可能显示酸性、碱性或中性 |
| B.混合溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| C.若a>b,则混合溶液中c(C1-)=c(NH4+)+c(NH3·H2O) |
D.若混合溶液显中性;则NH3·H2O的电离平衡常数为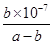 mol·L-1 mol·L-1 |
下列图示与对应叙述相符合的是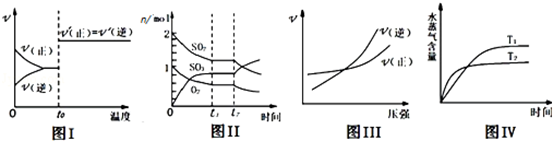
A.图I:反应CO+NO2 CO2+NO达平衡后,升高温度时反应速率随时间的变化 CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
B.图Ⅱ:反应2SO2+O2 2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化 2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
C.图Ⅲ:反应N2+3H2 2NH3在恒温情况下,反应速率与压强的关系 2NH3在恒温情况下,反应速率与压强的关系 |
D.图Ⅳ:反应CO2(g)+H2(g) CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化[ CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化[ |