下列对分子的性质的解释中,不正确的是
| A.水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 |
B.乳酸(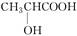 )有一对手性异构体,因为其分子中含有一个手性碳原子 )有一对手性异构体,因为其分子中含有一个手性碳原子 |
| C.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 |
| D.酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多 |
有BaCl2和NaCl的混合溶液2.0L,将它平均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl—离子完全沉淀。反应中消耗0.5mol H2SO4、2.0mol AgNO3。据此得知原混合溶液中的c(Na+)为
| A.0.5 mol·L-1 | B.0.75 mol·L-1 | C.1.5 mol·L-1 | D.1.0 mol·L-1 |
在电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是
| A.将盐酸逐滴加入食盐溶液 | B.将硫酸逐滴加入氢氧化钡溶液 |
| C.将硫酸逐滴加入氢氧化钠溶液 | D.将醋酸逐滴加入氨水 |
实验室常利用以下反应制取少量氮气:
NaNO2+NH4Cl=NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是
| A.NaNO2是氧化剂,NH4Cl是还原剂 |
| B.N2既是氧化产物,又是还原产物 |
| C.NH4Cl中的氮元素被还原,发生还原反应 |
| D.每生成1 mol N2时,转移电子的物质的量为3 mol |
根据以下几个反应:
①Cl2+2KI 2KCl+I2 ②2FeCl2+Cl2
2KCl+I2 ②2FeCl2+Cl2 2FeCl3
2FeCl3
③2FeCl3+2KI 2FeCl2+2KCl+I2④I2+SO2+2H2O
2FeCl2+2KCl+I2④I2+SO2+2H2O H2SO4+2HI
H2SO4+2HI
判断还原性由强到弱的顺序是
| A.I->Fe2+>SO2 >Cl- | B.SO2>Fe2+>I-> Cl- |
| C.SO2>I ->Fe2+> Cl- | D.Fe2+>I->Cl->SO2 |
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
| A.Na+、K+、OH-、Cl- |
| B.Na+、Cu2+、SO42-、NO3- |
| C.Mg2+、Na+、SO42-、Cl- |
| D.Ba2+、HCO3-、NO3-、K+ |