(6分)实验室里同学们正在探究氢氧化钠与硫酸能否发生化学反应。
【探究活动1】菲菲同学进行了如下实验。
她观察到的现象应该是(1) 。
她认为此现象说明生成了硫酸钠,因此能证明氢氧化钠与硫酸发生了反应。
【评价与交流】请你评价她的实验结论(2) 。
【探究活动2】琪琪同学为了证明同样的问题进行了另一个实验: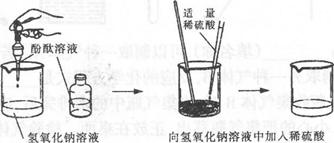
【搜集证据】滴人酚酞后观察到(3) ,滴入适量稀硫酸后观察到(4) 。
【解释与结论】用化学方程式表示滴入稀硫酸后产生现象的原因(5) 。
据此琪琪同学证明了氢氧化钠与硫酸能发生反应。
【反思与总结】由上述探究活动我们可以认识到,在判断一个反应能够发生时,如果不能证明有其它物质的生成,则应(6) 。
(7分)由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。某化学研究小组的同学欲对某种塑料袋的组成进行分析研究,测定样品中元素的质量比,设计了如图所示的实验装置。
(小资料:该种塑料袋只含碳、氢两种元素,燃烧产物为二氧化碳和水。图中碱石灰可以吸收空气中的二氧化碳与水蒸气)
(1)按上面连接好装置,在装入药品之前,必须进行的操作是。
(2)装置 A 中所发生的反应化学方程式为。装置中 MnO2 粉末的作用是。
(3)由于发生装置 A 制取的氧气中混有水蒸气,为不影响测定结果,装置B中盛放的试剂应该是_____________(写名称)。
(4)判断塑料袋试样中含有碳元素的依据是____________________________________。
(5)根据实验前后装置的质量变化测算出仪器D质量增重5.4g,仪器 E 质量增重 8.8g,则该塑料袋试样中碳元素与氢元素的质量比为______________。
(6)若实验过程中由于过氧化氢的量不足,塑料袋试样燃烧不充分,则该塑料试样中碳 元素与氢元素的质量比的测算结果(填“一定偏大”、“一定偏小”、“基本一致”之一)。
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习
小组对蓝色固体的成分进行了如下探究。请完成下列各题:
Ⅰ.猜想与假设:
猜想一:固体为CuCO3,理由:___________________(用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈______(填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
Ⅱ.资料查阅:
①Cu(OH)2和CuCO3晶体均不带结晶水;无水硫酸铜是白色固体,遇水会变成蓝色的硫酸铜晶体。
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
Ⅲ.设计与实验:
㈠固体的获取:
⑴将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体。
⑵判断固体已洗净的方法及现象_______________________________________。
㈡用下图所示装置,定性探究固体的成分。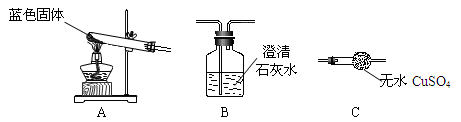
⑶小组同学将装置按 A、______、______(填“B”、“C”)的顺序组合进行实验,验证出猜想三是正确的,实验中:A中的现象为_________________________,C中的现象为______________________。
结论:固体为Cu(OH)2和CuCO3的混合物。
㈢固体成分定量测定:
已知Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为
200℃~220℃。设固体的组成为aCu(OH)2•bCuCO3。小组同学
用热分析仪对固体进行热分解,获得相关数据,绘成固体质量
变化与分解温度的关系如下图,请根据图示回答下列问题:
⑷写出AB、CD段发生反应的化学方程式: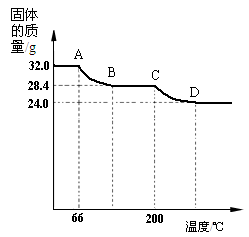
AB段:___________________________________;
CD段:___________________________________;
⑸通过计算可得:a:b=________。(请写出计算过程)
某化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究,查阅资料如下:
1、该牙膏摩擦剂由碳酸钙、氢氧化铝组成;
2、牙膏中其它成分遇到盐酸无气体生成;
3、碱石灰的主要成分为生石灰和氢氧化钠固体。
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀的质量,以确定碳酸钙的质量分数。请回答下列问题:
(1)B中反应生成BaCO3的化学方程式是 。
(2)C装置的作用是 。
(3)下列各项措施中,不能提高测定准确度的是 (填序号)。
| A.在加入盐酸之前,应排净装置内的CO2气体 |
| B.滴加盐酸不宜过快 |
| C.在A~B之间增添盛有浓硫酸的洗气装置 |
| D.在A~B之间增添盛有饱和碳酸氢钠溶液的洗气装置 |
(4)有同学认为该装置测定出来的碳酸钙质量分数会偏低,他的理由是
,解决方法是 。
(5)某同学认为不必测定B中生成的BaCO3质量,将B中的Ba(OH)2溶液换成浓H2SO4,通过测定C装置反应前后的质量差也可以测定CaCO3的质量分数。实验证明按此方法测定的结果明显偏高,原因是 。
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。请计算样品中碳酸钙的质量分数。(写出计算过程)
有下列装置,其中A是气体发生装置,B、C、D、E是气体收集装置,E还可作气体的净化装置(E装置有多个备用)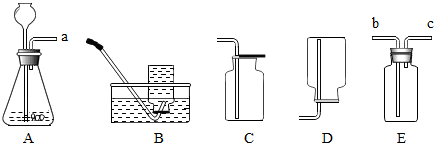
(1)当用大理石和盐酸制取CO2时,选取的收集装置是(填“B”或“C”或“D”)为了得到纯净、干燥的CO2,首先在E装置中注入足量的NaOH溶液来除去HCl,你认为该方法是否恰当并说明理由,然后在另一个E装置中注入浓硫酸,其作用是。
(2)当用过氧化氢溶液和二氧化锰来制取氧气时,A中发生反应的化学方程式为,若a与c相连来收集氧气,还需将装置E。
如图是实验室常用的两种气体制备、收集、净化的多种功能装置.请完成下列各题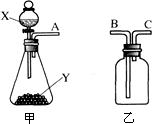
(1)若制备的气体是氢气,且产生的气体中不含酸性杂质气体,则试剂X常用;
(2)若X是过氧化氢溶液,Y是二氧化锰,将装置甲和乙通过A、C相连来制取气体,检查装置气密性后,还须将装置乙;
(3)为测定黄铜(Cu和Zn)中锌的质量分数,某化学小组只用甲装置:称取ag黄铜与足量的盐酸反应。欲计算黄铜中锌的质量分数,还须测定的数据有。