将(NH4)2SO4和Na2CO3两种溶液充分混合加热,发现有气泡产生且闻到刺激性气味。同学们对气体成分产生兴趣。
【查阅】CuO和NH3加热时发生反应:2NH3+3CuO N2+3Cu+3H2O
N2+3Cu+3H2O
【猜想】猜想一:气体是CO2
猜想二:气体是NH3
猜想三:气体是NH3和CO2
【讨论】(1)猜想一肯定不正确,理由是 ;
(2)因Na2CO3溶液呈 (填“酸”或“碱”)性,故有NH3产生。
【探究】为确定气体成分,设计如下装置(夹持装置未画出):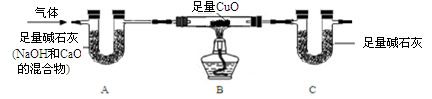
(1)实验后,取少量A中固体,加入稀盐酸,观察到 ,证明其中含CO2;
(2)B中观察到 ,证明含有NH3;
(3)(NH4)2SO4和Na2CO3两种溶液发生反应的方程式为: ;
(4)若B装置连同固体质量减轻4.8g,则C装置增加的质量为 ;
【反思】
(1)实验测得装置C增加的质量大于理论值,可能的原因是 ;
(2)氨气也是污染物,在C装置后连接下图装置,以吸收尾气中未参加反应的氨气。干燥管的作用是 (填序号)。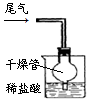
①防止氨气逸出 ②防止液体倒吸 ③防止盐酸挥发
(1)小方用下图所示装置对二氧化碳的灭火实验进行研究,实验的结论是______________________________________。
(2)【提出问题】二氧化碳能否支持燃烧?
【猜想假设】镁能在二氧化碳中燃烧。
【查阅资料】①氧化镁、氢氧化镁均是白色难溶于水的固体
②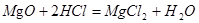
③ ↓
↓
【实验探究】
①下图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。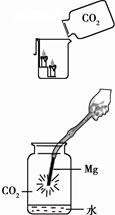
②为检验生成物的成分,做如下实验。
| 实验步骤 |
实验现象 |
实验结论和 化学方程式 |
|
| 向广口瓶中加入过量盐酸,充分反应后过滤,在滤纸上留有黑色固体。 |
I、将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯。 |
黑色固体燃烧,烧杯内壁出现白色浑浊。 |
黑色固体是; 涉及该步骤反应的化学方程式:。 |
| II、取少量滤液于试管中,逐滴加入氢氧化钠溶液。 |
有白色沉淀产生。 |
白烟的成分是。 |
③为了回收II中的白色沉淀,证明沉淀完全的实验方法是。
(要求写出步骤、试剂、现象和结论)。
【反思提高】通过此次实验的探究,你对燃烧的条件或二氧化碳的灭火有何新认识。
化学兴趣小组设计的创新实验是“火龙生字”,在成果展示现场,某同学用硝酸钾的热饱和溶液先在白纸上书写“火”字,晾干后白纸上出现硝酸钾晶体(见图1),用带火星的木条接触硝酸钾晶体,就会观察到白纸上写过字的地方燃烧并迅速蔓延,留下“火”字的黑色痕迹(见图2)。在场的同学对此产生了浓厚的兴趣,并进行了如下研究:
【提出问题】为什么附有硝酸钾的白纸更容易燃烧?
【查阅资料】硝酸钾受热易分解,生成亚硝酸钾(KNO2)和一种常见的气体单质。
【猜想与假设】对于生成的是什么气体,四位同学有如下猜测:
甲:二氧化氮; 乙:氮气; 丙:氧气; 丁:氢气;
同学丙指出不可能是二氧化氮、氢气,理由是:。
【进行实验】四位同学设计了实验对同学丙的猜想进行了验证,他们的操作方法是:,观察到的现象是,说明同学丙的猜想正确,硝酸钾分解的化学方程式是。
【解释与结论】白纸上写过字的地方更容易燃烧的原因是:
【反思与评价】为什么要用“硝酸钾的热饱和溶液”书写文字?已知硝酸钾在不同温度时的溶解度如下表:
| 温度/℃ |
20 |
40 |
60 |
80 |
100 |
| 溶解度/g |
31.6 |
63.9 |
110 |
169 |
246 |
你对上述问题的解释是:。
研究小组进行木炭还原氧化铁的探究活动。将木炭、氧化铁及试管充分烘干,并将木炭和氧化铁混合均匀、研磨。取适量上述混合物于试管中,用图1所示的装置加热(试管竖直向上,可使加热时的热量尽少散失)。

【提出问题】实验结束后,试管中的剩余固体X含有哪些成分,质量分别是多少?
【查阅资料】
铁的氧化物被还原时,是从高价铁的氧化物逐级还原成低价铁的氧化物,最后还原成金属铁。铁的氧化物及其部分性质如下: 为红色固体;
为红色固体;  和
和 均为黑色固体。其中,
均为黑色固体。其中, 具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
具有很好的磁性,能被磁铁吸引。三种氧化物均不溶于水,但能溶于稀盐酸,分别发生如下反应:
Fe2O3+6HCl ══ 2FeCl3+3H₂O
Fe3O4+8HCl ══ 2FeCl3+FeCl2+4H2O
FeO+2HCl ══ FeCl2 + H2O
黄色的 溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验
溶液中滴入无色的KSCN溶液,溶液变为红色,该实验常用于检验 ;
; 溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
溶液遇单质铁发生反应:2FeCl3 + Fe = 3FeCl2,溶液变为浅绿色。
【猜想】固体X可能含有:① ②
② ③
③ ④⑤
④⑤
【实施实验】
目的:确定固体X的组成。
| 步骤 |
操作 |
主要现象 |
结论 |
| I |
取部分冷却后的固体X倒在滤纸上,用磁铁充分吸引。 |
部分固体被吸引到磁铁上 |
可能有 或 或 |
| II |
取滤纸上的剩余固体少量,放入图2所示的试管a中,通入氧气,用酒精灯加热。 |
固体剧烈燃烧, b中溶液变浑浊 |
一定有 |
| III |
另取滤纸上的剩余固体少量,放入试管中,加入足量的稀盐酸。 |
无明显现象 |
一定没有 |
| IV |
取步骤I磁铁上的固体少量,放入试管中,逐滴加入稀盐酸。 |
产生。 |
一定有 |
| V |
在步骤IV所得溶液中逐滴加入。 |
溶液不变红色 |
一定没有 |
【反思改进】
同学们讨论发现,用上述实验方法不能确定固体X中一定没有 ,理由是。
,理由是。
为确定固体X中是否含Fe3O4并测定其中各成分的质量,同学们又进行了以下实验:
| 步骤 |
操作 |
数据 |
| I |
重新取部分冷却至室温的固体X,称量其质量为m1。 |
m1 =" 17.9" g |
| II |
将称量好的固体X全部放入图3所示的锥形瓶中,称量整套装置及药品的质量为m2;打开分液漏斗旋塞,放入足量稀盐酸后关闭旋塞,待没有气泡产生并恢复至室温,再次称量整套装置及药品的质量为m3。 |
m2 =" 317.9" g m3 = 317.3.g |
| III |
将锥形瓶中剩余的固体过滤、洗涤并干燥,称量其质量为m4。 |
m4 =" 1.1" g |
【获得结论】
(1)为确定固体X中是否含 ,m1~m4中应该用到的数据有。
,m1~m4中应该用到的数据有。
(2)固体X的成分及质量分别是。
小红同学为探究R、X、Y和Z四种金属的活动性顺序,进行以下实验。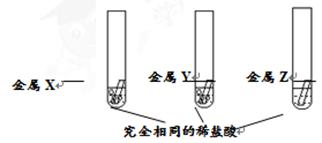
(1)将红色金属R在石棉网上加热,观察到,证明R是铜。
(2)如上图所示,将X、Y和Z分别加入三份完全相同的稀盐酸中,观察到金属X、Y的试管中均有气泡产生,金属Z的试管中无明显现象。
①金属X的试管中,最终还能观察到溶液变为浅绿色,证明X为。
②金属Y可能是(填字母序号)。
| A.Mg | B.Ag | C.Hg | D.Zn |
③四种金属中,在金属活动性顺序表中位于氢后的是,为进一步确定位于氢后金属的活动性相对强弱,还应补充的实验方案为__________(试剂可自选)。
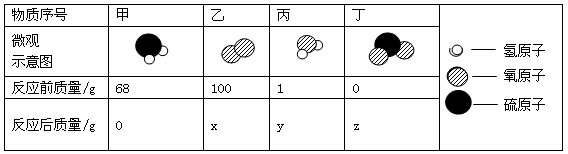
质量守恒定律是化学反应遵循的普遍规律。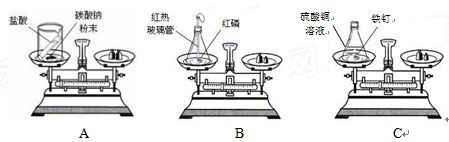
|