(5分)某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律: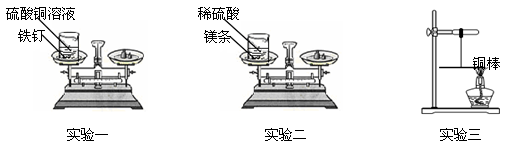
【设计并实验】
实验一:将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量。然后将铁钉浸到硫酸铜溶液中,观察现象。待反应一段时间后溶液颜色改变时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验二:将盛有稀硫酸的烧杯和镁条一起放在托盘天平上称量,然后将镁条浸到稀硫酸中,观察现象。待反应一段时间后不再放出气泡时,将盛有反应后物质的烧杯放在托盘天平上称量,记录所称的质量。
实验一和实验二的数据见下表:
| 编 号 |
实验一 |
实验二 |
| 反应前/g |
118.4 |
112.6 |
| 反应后/g |
118.4 |
112.4 |
实验三:用细线系住铜棒中点使之平衡,然后在铜棒一端用酒精灯加热。加热一段时间后,观察到铜棒的平衡情况是 。
【分析与讨论】
(1)在这三个实验中,你认为:实验 正确反映了反应物与生成物之间的质量关系,由此得出的结论是:在化学反应中生成物的总质量与反应物的总质量相等,请从原子的角度分析结论正确的理由是 。
(2)另外两个实验得出的结论是:在化学反应中生成物的总质量与反应物的总质量不相等,你认为导致这一结论错误的原因是 (只写其中一个实验的原因即可)。
【实验反思】小组成员从不能正确反映反应物和生成物之间质量关系的两个实验中,找出了实验设计中的不当之处,并达成了以下共识:设计实验验证质量守恒定律时,对于有空气中的气体(成分)参与或有气体生成的化学反应,一般应使反应在 中进行。
阅读材料:过氧化钠在工业上有广泛的用途,常用做漂白剂、杀菌剂、消毒剂、去臭剂、氧化剂等。过氧化钠为淡黄色粉末,在空气中吸收水分和二氧化碳的同时放出氧气。与水反应,生成氢氧化钠和过氧化氢,由于反应放出大量的热,后者很快分解成水和氧气。过氧化钠能与稀酸反应。过氧化钠相对密度为2.805,难溶于乙醇,有氧化性,易引起燃烧爆炸,应避免与有机物和可燃物质接触。钠在氧气中燃烧可生成过氧化钠。
请回答下列问题:
(1)过氧化钠的物理性质(写两点)、;
过氧化钠的化学性质(写两点)、。
(2)下列有关过氧化钠的说法正确的是
| A.过氧化钠应密封保存 |
| B.过氧化钠可作供氧剂 |
| C.生成过氧化钠的反应属于分解反应 |
| D.在生成过氧化钠的反应中,氧气体现氧化性 |
(3)写出过氧化钠与水反应时,发生的所有化学反应的文字表达式。
(4)欲量取一定量稀酸与过氧化钠反应。使用量筒量取液体时,视线要与量筒内液体__________保持水平,再读出所取液体的体积数。下图为量筒的一部分,该量筒中液体的体积读数为______mL。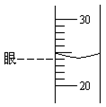
自然界的物质是多种多样的,我们可以用分类的方法来认识各种物质。物质的分类标准有多种,可以是物质的组成,也可以是物质的性质以及用途等。请对以下几种物质按照不同标准进行分类:氮气、河水、二氧化硫、双氧水、空气、冰(要求每种分类只包含三种物质)。
(1)分类标准一:,包括的物质:。
(2)分类标准二:,包括的物质:。
(3)分类标准三:,包括的物质:。
我们每时每刻都生活在空气的“海洋”里。科学家很早就开始了对空气的研究。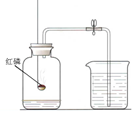
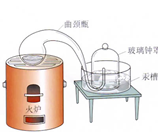
图Ⅰ图Ⅱ
(1)空气主要由__________和氧气组成,它们的体积比约为。
(2)实验室中可用图Ⅰ所示的装置粗略研究空气的组成。反应的文字表达式是,红磷燃烧的主要现象为。
(3)200年前,拉瓦锡用图Ⅱ所示的装置研究了空气的组成。他把少量汞放在密闭的容器中
连续加热,得到了红色的氧化汞粉末,同时钟罩内的汞液面上升。该化学反应的文字表达式是。汞液面上升的原因是。
(4)空气在标准状况下的密度是1.29 g/L,以下四种气体中只能用排空气法收集的是,
既能用排水法收集,又能用向下排空气法收集的是。
| 气体 |
A |
B |
C |
D |
| 标准状况下密度(g/L) |
1.997 |
1.250 |
0.771 |
0.717 |
| 在水中的溶解性 |
可溶 |
难溶 |
易溶 |
难溶 |
下列图示的化学实验基本操作中,正确的是
鉴别空气、氧气和二氧化碳三瓶气体,最常用的方法是
| A.观察颜色 | B.将燃着的木条分别伸入集气瓶中 |
| C.分别测定它们的密度 | D.将气体分别通入澄清石灰水中 |