室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,下列说法错误的是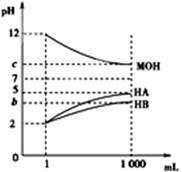
A.HA为强酸,HB为弱酸
B.若b+c=14,则MOH为弱碱
C.若c=9,则稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为HA>MOH>HB
D.若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)=c(M+)
下列说法正确的是
| A.SO2漂白织物 |
| B.用热的纯碱溶液清洗油污 |
| C.食醋清洗水垢 |
| D.次氯酸消毒餐具 |
下列说法正确的是
| A.医用酒精、冰醋酸、液态HCl都是混合物 |
| B.水晶、玛瑙和刚玉的主要成分都是二氧化硅 |
| C.淀粉、油脂和蛋白质都能发生水解反应 |
| D.铁遇到冷的浓硝酸和稀硝酸均会钝化 |
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是
| A.与铜质水龙头连接处的钢质水管易发生腐蚀 |
| B.明矾常作为净水剂,双氧水通常可用于作杀菌消毒 |
| C.食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜 |
| D.金属钠、镁等活泼金属着火时,可以使用泡沫灭火器灭火 |
人们日益重视环境问题,下列说法不正确的是
| A.装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 |
| B.人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 |
| C.煤燃烧时加入少量的石灰石可以减少废气中的二氧化硫排放 |
| D.我国自实施“限塑令”以来,“白色污染”在一定程度上得到有效遏制 |
化学在生产和日常生活中有着重要的应用。下列叙述正确的是
| A.单质硅是将太阳能转化为电能的常用材料 |
| B.硅酸钠的俗名为玻璃,可用于制备硅胶和木材防火剂 |
| C.用浓H2SO4刻蚀工艺玻璃上的纹饰 |
| D.SO2具有氧化性,可用来漂白纸浆 |