在一定条件下,将4mol A充入体积不变的2 L密闭容器中,发生下述反应,: 2A(g) 2B(g)+C(g), 5 min后达到平衡,此时B的浓度为1.6 mol/L。下列判断正确的是
2B(g)+C(g), 5 min后达到平衡,此时B的浓度为1.6 mol/L。下列判断正确的是
A.反应在前5 min内,v(A)=0.16 mol/( L·min)
B.其他条件不变,若增大A的浓度,则达平衡时A的转化率会增大
C.其他条件不变,降低温度,平衡时n(B)=3mol,则反应的ΔH<0
D.平衡后移走2 mol B和1mol C,在相同条件下再达平衡时,c(A)<0.2 mol/L
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法正确的是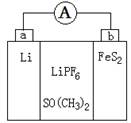
| A.该装置将电能转化为化学能 |
| B.Li+向a极移动 |
| C.可以用水代替SO(CH3)2做溶剂 |
| D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S |
NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1.0 L 1.0 mol·L-1的NaClO水溶液中含有的氧原子数为NA |
| B.25 ℃时1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| C.2.24 L的2H35Cl分子中的中子数是1.9NA |
| D.某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,形成N—H键的数目为0.6NA |
下列有关说法不正确的是
| A.实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则水电离的热化学方程式为:H2O(l) H+(aq)+OH-(aq)ΔH= +57.3 kJ·mol-1 H+(aq)+OH-(aq)ΔH= +57.3 kJ·mol-1 |
| D.生铁发生吸氧腐蚀和析氢腐蚀的负极反应均为:Fe-2e- =Fe2+ |
下列叙述错误的是
| A.化学反应能够制造出新的物质,但不能制造出新的元素 |
| B.用Na2S作沉淀剂,可除去废水中的Cu2+和Hg2+ |
| C.玻璃钢是一种合金,广泛用于汽车车身 |
| D.只要符合限量,“食用色素”、“苯甲酸钠”、“亚硝酸盐”可以作为某些食品的添加剂 |
利用下表提供的实验器材(规格和数量不跟)能完成相应实验的是
| 选项 |
实验器材(省略夹持装置) |
相应实验 |
| A |
烧杯、玻璃棒、短颈玻璃漏斗 |
苯甲酸的重结晶 |
| B |
烧杯、玻璃棒、胶头滴管、分液漏斗 |
用溴水和CCl4除去NaBr溶液中少量NaI |
| C |
烧杯、玻璃棒、胶头滴管、容量瓶 |
用固体NaCl配制0.5 mol/L NaCl溶液 |
| D |
烧杯、玻璃棒、胶头滴管 |
用盐酸除去BaSO4中少量BaCO3 |