(1)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g) 2CO2(g)+S(l)△H=—270 kJ/mol
2CO2(g)+S(l)△H=—270 kJ/mol
一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,在催化剂作用下发生反应生成CO2(g)和S(l)。
①若反应进行到25min时测得CO2的体积分数为0.5。则前25min的反应速率v(CO)=_____;
②若反应进行到40min时反应达到平衡状态,此时测得容器中气体的密度比反应前减少了12.8g/L,则化学平衡常数K=________;
③若反应在不同条件下进行,反应体系总压强随时间的变化如图甲所示:

图甲中三组实验从反应开始至达到平衡时的反应速率v(CO)由大到小的次序为_________(填实验序号);与实验a相比,c组改变的实验条件可能是__________;若用P0表示开始时总压强,P表示平衡时总压强,用α表示CO的平衡转化率,则α的表达式为______________。
(3)汽车尾气和工业废气中均含有的NO2,NO2是大气污染物之一。消除NO2的污染还可用电解法,方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。 Pt乙为 极,电解池中生成N2O5的电极反应式是 。
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 。
A.Mg2+ B.Fe2+C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
回答下列问题:
①操作Ⅰ的名称是 ,操作Ⅱ的名称是 。
②写出在空气中煅烧FeCO3的化学方程式 。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计的下列滴定方式,最合理的是 。(夹持部分略去)(填字母序号)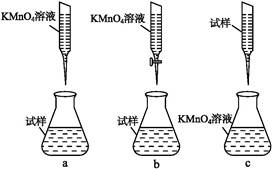
③写出滴定过程中反应的离子方程式: 。
④计算上述样品中FeSO4·7H2O的质量分数为 。
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸与铜反应制取硫酸铜。该反应的化学方程式是 ,此法的最大缺点是 。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示: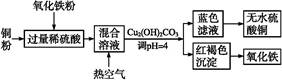
稀硫酸、铜和氧化铁反应的化学方程式是 ;向混合溶液中通入热空气的反应的离子方程式是 ;由滤液得到无水硫酸铜的实验操作是 。
(2)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。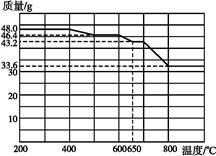
根据图像推断670 ℃时Fe2O3还原产物的化学式为 ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论) 。
仪器自选。可供选择的试剂:稀硫酸、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
已知2Na2SiO3+2NaAlO2+2H2O Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 。
(3)固体X的主要成分是 ,过滤时使用的玻璃棒,其作用是 。
(4)滤液B中溶质的主要成分是 (填化学式);滤液E、K中溶质的主要成分是 (填化学式),写出该溶液的一种用途 。
(5)在流程中,选用CO2作酸化剂,为什么不选用盐酸? 。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O
当反应中有2.408×1024个电子发生转移时,还原剂的质量为
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
x |
2.0 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2.0 |
1.0 |
0.4 |
1.6 |
3 |
①实验1中以v(CO2)表示的反应速率为(要求2位有效数字,下同);实验2达到平衡时CO的体积分数为。
②若反应的平衡常数大,处理CO的效率高,则增大该反应平衡常数的措施有。
③900℃时,该密闭容器中,加入4 molCO,3 mol H2O ,4mol CO2和2.4mol H2,比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
④一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的有。
A.容器中气体的平均分子量不随时间而变化
B.消耗1molH2的同时消耗1molCO
C.容器中气体的密度不随时间而变化
D.CO2的体积分数不随时间而变化
(3)汽车尾气的排放对空气造成污染。目前采用的是在汽车排气装置中安装一个净化器,可以有效将尾气中的有害气体转化。如:
①CO (g)+NO2(g) =CO2(g) + NO (g)ΔH =-a kJ/mol (a>0)
② 2CO (g)+2NO(g) =2CO2(g) )+ N2 (g)ΔH =-b kJ/mol (b>0)
若用标准状况下3.36LCO还原NO2至N2(CO完全反应)时放出的热量为kJ(用含a和b的代数式表示,下同);并写出该反应的热化学方程式。
甲、乙、丙、丁、戊、己为原子序数依次增大的短周期主族元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,乙元素最高化合价与最低价的代数和为0;丙、丁、戊的最高价氧化物的水化物之间都能发生反应。用化学用语回答下列问题:
(1)甲的阴离子的结构示意图为;用电子式表示乙与戊形成化合物的过程。
(2)丙、丁、戊的离子半径由大到小的顺序为;乙、戊、己的氢化物的还原性最弱的是。
(3)写出由甲乙两元素形成的化合物中,既含有极性键又含有非极性键,且相对分子质量最小的物质的结构式;该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为。
(4)丙、丁的最高价氧化物的水化物之间发生反应的离子方程式为。由甲、丙、戊、己中部分元素形成的两种化合物的水溶液之间可以发生反应,该化学方程式为:。
(5)按下图电解丙和己形成化合物的饱和溶液,该装置可用于家庭用水的消毒。写出该电解池中发生反应的总反应方程式:。