日用牙膏的主要成分有:活性物质、摩擦剂、甘油等。假设牙膏中摩擦剂成分为CaCO3、SiO2、Al(OH)3中的一种或几种物质组成,牙膏中其他成分均可溶于盐酸,且无气体产生。
(1)牙膏中添加甘油主要作用____。
为进一步探究牙膏中摩擦剂成分,进行了以下探究:
I.摩擦剂成分的定性检验:设计实验方案,验证假设。请写出实验步骤以及预期现象和结论(可不填满也可补充)。可选的试剂:稀盐酸,稀硫酸,NaOH溶液,澄清石灰水
| 实验步骤 |
预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 |
有难溶物存在 |
| 步骤2: |
①有无色气泡产生,说明有CaCO3; ②_________,说明有______。 |
| 步骤3: |
|
| …… |
|
II.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
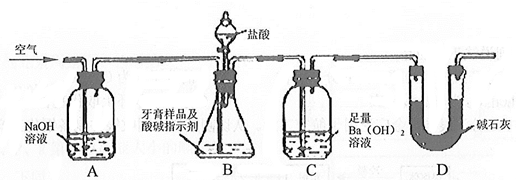
依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其主要作用 。
(3)仪器C中选择Ba(OH)2而不选择Ca(OH)2溶液原因:① 。② 。
(4)下列各项措施中,能提高测定准确度的是____(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.缓慢滴加稀盐酸
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10. 00g样品三份,进行三次测定,洌得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_______。若改测定C中生成BaCO3质量为测定装置C在吸收CO2前后的质量差来确定CaCO3的质量分数,两方法测定的结果_______(填“相同”或“不同”),原因是 ___。
心酮胺是治疗冠心病的药物。它具有如下结构简式: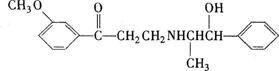
下列关于心酮胺的描述,错误的是
| A.可以在催化剂作用下和溴反应 | B.可以在碱性条件下发生水解反应 |
| C.能够使酸性高锰酸钾溶液褪色 | D.可以和浓硫酸与浓硝酸的混合液反应 |
能解释下列原理的离子反应方程式正确是
| A.用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+ |
| B.用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O |
| C.用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++ Cu=Fe2++ Cu2+ |
| D.用氢氧化钠溶液除去铝表面的氧化膜: Al2O3+2OH-+3H2O=2[Al(OH)4]- |
科学家P.Tatapudi等人首先使用在空气中电解水(酸性条件下)的方法在阳极制得臭氧,阴极制得过氧化氢。电解总方程式为:3H2O+3O23H2O2+O3,下列说法正确的是
| A.电解产物在应用中都只能作为氧化剂 | B.电解一段时间后,溶液pH不变 |
| C.每生成1 mol O3转移电子数为3 mol | D.阳极的反应:3H2O→O3+6H++6e- |
已知R、M、T、G、J为原子序数依次增大且相邻的同一短周期主族元素。下列说法一定正确的是
| A.若R、M的最高价氧化物的水化物是碱,则M(OH)n+1的碱性比R(OH)n的碱性强 |
| B.若T(OH)n为两性氢氧化物,则J元素形成的单质存在同素异形现象 |
| C.若J的氢化物是常见的强电解质,则M单质是光导纤维的主要成分 |
| D.若M的最高正价为+4,则五种元素全是非金属元素 |
已知CH4(g)+2O2(g) ==CO2(g)+2H2O(l); ΔH=–Q1kJ·mol-1 ,
2H2(g)+O2(g)=2H2O(g);△H2=–Q2 kJ· ,
,
2H2(g)+O2(g) =2H2O(l);△H2=–Q3 kJ· 。
。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为
| A. 0.4Q1+0.05Q3 | B.0.4Q1+0.05Q2 | C.0.4Q1+0.1Q3 | D.0.4Q1+0.2Q2 |