【原创】实验是化学研究的基础,下列关于各实验装置的叙述正确的是
| A.装置1可以制备氢氧化亚铁 |
| B.装置2用来除去C2H4中的杂质SO2 |
| C.装置3分液漏斗中盛硝酸能证明非金属性N>C>Si |
| D.装置4可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,下列措施,不能使溶液颜色变浅的是
HBr+HBrO,下列措施,不能使溶液颜色变浅的是
| A.通入乙烯气体 | B.通入SO2气体 | C.加入NaF晶体 | D.加入NaI晶体 |
下列有关化学用语表示正确的是
A.四氯化碳分子比例模型:  |
B.COS的电子式是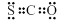 |
| C.次氯酸的结构式为 H-Cl-O | D. O2-离子结构示意图: O2-离子结构示意图: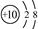 |
下列属于物质化学变化的是
| A.结晶法除去NaCl中少量的KNO3 | B.气球充入过量的空气,爆炸 |
| C.金属钠有强还原性,能与水反应 | D.氯化氢溶于水生成盐酸 |
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是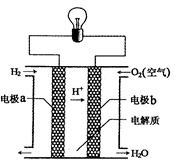
| A.该电池工作时电能转化为化学能 |
| B.通入氢气的一极是负极 |
| C.外电路中电子由电极b通过导线流向电极a |
| D.该电池的总反应:2H2+O2=2H2O |
根据下表中的数据,结合学过的化学知识,判断下列说法正确的是
| 物质 |
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
| 沸点/℃ |
1465 |
1412 |
181(升华) |
57.6 |
A.以上四种物质中,只有SiCl4是共价化合物
B.若上述数据变化规律具有普遍性,则可预测:LiCl 的沸点大于BCl3的沸点
C.因为AlCl3的沸点低,所以工业上可用电解熔融AlCl3制备Al
D.据上述数据,可判断NaCl、MgCl2为分子晶体