实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应如下:

已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高于250℃;④苯甲醇沸点为205.3℃。

实验步骤如下:
①向图l所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。然后用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10 mL 10%碳酸钠溶液洗涤,10 mL水洗涤,然后分液,将水层弃去,所得醚层进行实验步骤③。
③将分出的醚层,倒入干燥的锥形瓶中,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2 所示的蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必须改变加热方式、冷凝方式,继续升高温度并收集205℃~206℃的馏分得产品A。
④将实验步骤②中保留待用的水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需 (仪器名称)。
(2)步骤②中饱和亚硫酸氢钠溶液洗涤是为了除去 ,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生的原因 。
(3)步骤③中无水硫酸镁的作用是 ,锥形瓶上要加塞的原因是 ,产品A为 。
(4)步骤③中蒸馏除去乙醚的过程中采用的加热方式为 ;蒸馏得产品A的加热方式是 。
(5)步骤④中提纯产品B时所用到的实验方法为_______。
制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:___________________________ 。
(2)收集氨气应使用法,要得到干燥的氨气可选用做干燥剂。用______方法检验氨气是否已收集满。
(3)用左上图装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是。
下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑥ |
⑦ |
||||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 4 |
② |
④ |
⑨ |
(1)10种元素中,化学性质最不活泼的是,除⑩外原子半径最大的是。
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是。
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为。
(4)元素⑦的氢化物的化学式为;该氢化物和元素②单质反应的化学方程式为。
(5)①⑨形成的化合物灼烧时火焰焰色为;该化合物的溶液与元素⑧的单质反应的化学方程式为。
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式____________________。
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为 ___;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为 _____;⑦⑧⑨形成氢化物的稳定性由强到弱顺序为_____________________。
利用氧化还原反应原理配平
NH3 + Cl2 N2 + NH4Cl
N2 + NH4Cl
在反应中元素被氧化,是还原产物。当反应中有0.3mol电子发生转移时,生成N2的体积(标准状况)L。
(6分)按下图装置实验,A、B两烧杯分别盛放200 g 10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发)。a、b、c为石墨电极,d为铜电极.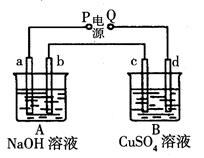
(1)标准状况下,b极产生气体的体积为__________L。
(2)c极上析出固体的质量为____________g。
为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏。化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。CCl4+H2 CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
CHCl3+HCl此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。
在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。
| 实验 序号 |
温度℃ |
初始CCl4浓度 (mol·L—1) |
初始H2浓度(mol·L—1) |
CCl4的平衡转化率 |
| 1 |
110 |
1 |
1.2 |
A |
| 2 |
110 |
1 |
1 |
50% |
| 3 |
100 |
1 |
1 |
B |
(1)此反应在110℃时平衡常数为。
(2)实验l中,CCl4的转化率A50%(填“大于”、“小于”或“等于”)。
(3)实验3中,B的值(选填序号)。
A.等于50%B.大于50%
C.小于50% D.从本题资料,无法判断
(4)120℃,在相同条件的密闭容器中,分别进行H2的初始浓度为2 mol·L-1和4 mol·L-1的实验,测得反应消耗CCl4的百分率(x%)和生成物中CHCl3,的百分含量(y%)随时间(t)的变化关系如图(图中实线是消耗CCl4的百分率变化曲线,虚线是产物中CHCl3的百分含量变化曲线)。在图中的四条线中,表示H2起始浓度为2mol·L一1实验的消耗CCl4的百分率变化曲线是 ________(选填序号)。