【化学——选修3:物质结构与性质】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显____价,A的电负性______B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因___________;组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 ;
| 共价键 |
C-C |
C-N |
C-S |
| 键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:

| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:_______________;其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________(填字母);
A.金属键
B.离子键
C.极性键
D.非极性键
E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为_______g/cm3(用含a、NA的式子表示)。
请回答下列化学有关问题:
(1)现代工业将煤汽化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的用途。
①已知:2C(s)+O2(g)=2CO(g);ΔH1 , 2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g)  CO(g)+H2(g);ΔH=。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH=。(用含ΔH1、ΔH2的代数式表示)
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)  CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验测得相关数据如下图1和图2。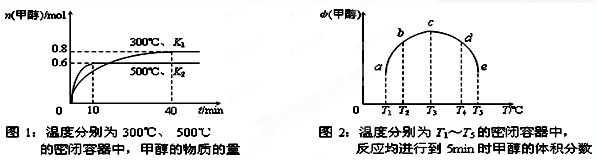
a. 该反应的ΔH30(选填“<”、“>”或“=”,下同), K1K2。
b. 将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有。
(2)煤汽化后的煤渣可提炼重金属。右图为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况。据图分析: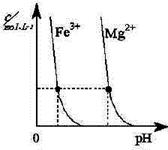
该温度下,溶度积常数的关系为:Ksp[ Fe(OH)3]____Ksp[Mg(OH)2]
(填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
由乙烯和其他无机原料合成环状化合物E,其合成过程如下:(水及其他无机产物均已省略)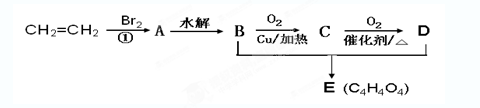
试通过分析回答下列问题:
(1)写出C的结构简式__________________
(2)物质X与A互为同分异构体,则X的结构简式为_________________________
(3)指出上图变化过程中①的有机反应类型_______________________
(4)D物质中官能团的名称____________________________
(5)写出B和D生成E的化学反应方程式_________________________(注明反应条件)
A、B、C、D、E为中学化学常见的单质或化合物,其相互转化关系如下图所示。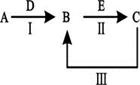
(1)若A为短周期常见金属单质,B、C均为含A元素的盐,且B溶液的pH>7,C溶液pH<7。用离子方程式表示B溶液pH>7的原因;
(2)若A是淡黄色化合物;常温下D是无色气体;C为常见强碱,含有的阴、阳离子均为10电子粒子。
① C中所含化学键的类型是;
②写出反应I的化学方程式;
③将一定量的气体D通入2 L C的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中所含溶质的化学式为,a点溶液中各离子浓度由大到小的顺序是。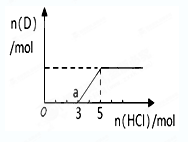
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液
(2)各取5mL上述溶液,分别加热(温度相同),pH较小的是________溶液
(3)H2SO4溶液和NH4Cl溶液中由水电离出的c(H+)之比为__________
(4)取5mL NH4Cl溶液,加水稀释至50mL,c(H+)__________ 10-6mol·L-1(填“>”、“<”或“=”),
c(NH4+)/c(H+)_______________(填“增大”、“减小”或“不变”)
CO2、SO2、NOx 是对环境影响较大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径。
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx 浓度的有(填字母)
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。写出用合成气(CO和H2)生产甲醇的化学方程式,已知该反应合成1 mol液态甲醇吸收热量131.9 kJ, 2H2 (g) + CO(g) + 3/2O2g) =CO2 (g) +2H20 (g)△H =-594.1 kJ·mol-1,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式。
(3)有人设想以下图所示装置用电化学原理将CO2、SO2转化为重要化工原料。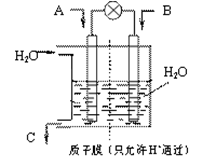
若A为CO2,B为H2,C为CH3OH,则通入CO2的一极为极;若A为SO2,B为O2,C为H2SO4。则负极的电极反应式为;
(4)①在研究氮的氧化物的转化时,某小组查阅到以下数据:17℃、1.01×105 Pa时,
2NO2(g) 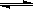 N2O4(g)△H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1,
N2O4(g)△H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4和NO2的混合气体达到平衡时,若 c (NO2) =" 0.0300" mol·L-1,
c (N2O4)=(保留两位有效数字);
②改变上述体系的某个条件,达到新的平衡后,测得混合气体中 c (NO2) =" 0.04" mol·L-1, c (N2O4) =" 0.007" mol·L-1,则改变的条件为;