某同学为研究电化学原理,使用KC1盐桥设计如图所示实验装置。下列分析合理的是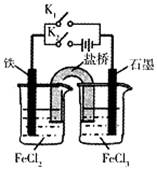
| A.闭合K2断开K1,铁电极上发生的反应为2Cl——2e—=Cl2↑ |
| B.闭合K1,断开K2,盐桥中的氯离子向石墨电极移动 |
| C.闭合K1,断开K2,向右侧烧杯中滴加几滴铁氰化钾溶液,溶液中产生蓝色沉淀 |
| D.无论闭合K1断开K2,还是断开K1闭合K2,铁电极上发生的反应都是Fe—3e—=Fe3+ |
人早晨不吃早餐,血糖会降低。一个人早晨吃了一个馒头,现从此人的消化道中取一些液体。
(1)对液体进行一些处理后,加入银氨溶液,在合适的条件下,产生了银镜现象,能否说明淀粉已完全水解?为什么?______________________________________________。
(2)如果反应需要1 mol银氨离子,则反应消耗了________mol葡萄糖,反应后葡萄糖所对应生成的物质的结构式为______________________________________。
(3)此人所吃的馒头被吸收的途径是__________________________________。
(4)此人吃完早餐后立即到操场上跑了几圈,发现浑身有些乏力(血糖降低的原因),则血液中的血糖靠________分解补充,________则为肌肉活动提供能量。
(5)此人大量吃糖后,血液中的葡萄糖会随________排出体外。医学上常用加入CuSO4和NaOH溶液微热生成沉淀来证明,写出其化学方程式_________________________________。
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。下列说法不正确的是 ( )。
| A.淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 |
| B.淀粉水解的最终产物能发生银境反应 |
| C.向蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 |
| D.脂肪能发生皂化反应,生成甘油和高级脂肪酸钠 |
对下列各有机物的有关叙述正确的是 ( )。
| A.取淀粉与稀硫酸共热后的溶液,加入新制银氨溶液中共热,没有银镜产生,说明淀粉尚未水解成葡萄糖 |
B.结构式为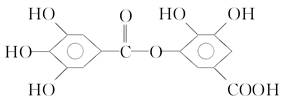 的有机物,可以在稀酸催化下发生水解反应,但水解生成产物只有一种 的有机物,可以在稀酸催化下发生水解反应,但水解生成产物只有一种 |
| C.油脂在稀硫酸或氢氧化钠水溶液中均可发生水解反应,且水解产物相同 |
| D.在苯环上有1个羟基,1个相对分子质量为43的烃基,属于酚类的同分异构体有3种 |
在下列物质中:①K2SO4;②HCHO;③MgSO4;④Hg(NO3)2;⑤NH4Cl;⑥KOH
能使蛋白质变性的是( )。
| A.②④⑥ | B.①③⑤ | C.①②③ | D.④⑤⑥ |
下列说法正确的是 ( )。
A.蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物
B.氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用
C.使用太阳能热水器、沼气利用、玉米制乙醇都涉及生物质能的利用
D.石油、煤、天然气、可燃冰、植物油都属于化石燃料