【原创】500℃时,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)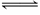 2NH3(g) ΔH=-92 kJ/mol。
2NH3(g) ΔH=-92 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质的物质的量/mol |
平衡时N2或NH3转化率 |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
|||
| ① |
1 |
3 |
0 |
α1 |
放出热量18.4kJ |
| ② |
0 |
0 |
2 |
α2 |
吸收热量b kJ |
| ③ |
2 |
6 |
0 |
α3 |
放出热量c kJ |
下列叙述错误的是
A.b = 73.6
B.转化率:α1+α3 >1
C.达平衡时氨气的体积分数:①>③
D.若改为绝热容器,则三个容器内反应的平衡常数:②>①>③
以下操作或实验装置不能用于分离物质的是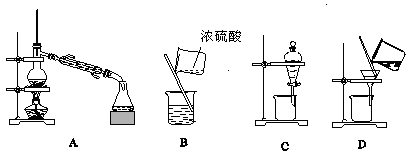
下列关于溶液和胶体的叙述,正确的是
| A.向胶体中加入电解质溶液,能发生聚沉 |
| B.溶液呈电中性的,胶体是带电的 |
| C.溶液能透过滤纸,胶体不能透过滤纸 |
| D.溶液和胶体的本质区别是能否发生丁达尔现象 |
在xR2+ + yH+ + O2 = mR3+ + nH2O的离子反应中,系数m的值
| A.2x | B.4 | C.y/2 | D.2 |
下列有关氧化还原反应的叙述中正确的是
| A.有单质参加或有单质生成的反应一定是氧化还原反应 |
| B.氧化还原的本质是元素化合价的升降 |
| C.失电子的反应物在反应中作氧化剂,反应中被还原 |
| D.金属单质在化学反应中一定作还原剂 |
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是
| A.金属冶炼 | B.燃放鞭炮 | C.食物腐败 | D.点制豆腐 |