电解Na2SO4溶液生Na2SO4和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)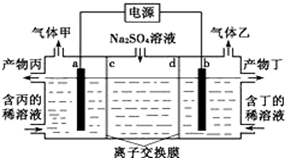
| A.a极反应式为:2H++2e一=H2↑ |
| B.产物丁为NaOH |
| C.c为阳离子交换膜 |
| D.每转移0.2mol电子,产生1.12L气体甲 |
A、B、C、D都是含碳、氢、氧的单官能团化合物,A水解得B和C,B氧化可以得到C或D,D氧化也得到C。若M(X)表示X的摩尔质量,则下式中正确的是
A.M(A)="M(B)+M(C)" B.2M(D)=M(B)+M(C)
C.M(B)<M(D)<M(C) D.M(D)<M(B)<M(C)
现在为婴儿特制成一种新型的尿布——“尿不湿”.这种尿布表面涂有一种既能吸水又能保留水的物质.据你的推测,这种特殊物质的结构可能是
A.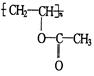 |
B.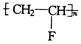 |
C.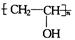 |
D.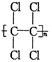 |
某有机物既能被氧化,又能被还原,且氧化后与还原后的产物能发生酯化反应,所生成的酯又能发生银镜反应,则该有机物是
| A.CH3OH | B.HCHO | C.HCOOH | D.CH3CH2CHO |
图1和图2是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质是 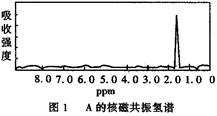
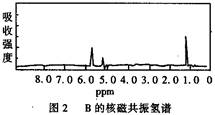
A.A是C 3H 6;B是C 6H 6B.A是C 2H 6;B是C 3H 6
C.A是C 2H 6 ;B是C 6H 6D.A是C 3H 6;B是C 2H 6
丁香油酚的结构简式是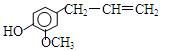 ,该物质不应有的化学性质是
,该物质不应有的化学性质是
①可以燃烧;②可以跟溴加成;③可以使酸性KMnO4溶液褪色;④可以跟NaHCO3 溶液反应;⑤可以跟NaOH溶液反应;⑥可以在碱性条件下水解
| A.①③ | B.③⑥ | C.④⑤ | D.④⑥ |