一定条件下存在反应C(s)+H2O(g)  CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
| 容器 |
甲 |
乙 |
丙 |
| 容积 |
0.5 L |
0.5 L |
V |
| 温度 |
T1 ℃ |
T2 ℃ |
T1 ℃ |
| 起始量 |
2 molC 1 molH2O |
1 molCO 1 molH2 |
4 molC 2 molH2O |
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V>0.5L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1< T2
目前常用的镍镉蓄电池,其电池总反应可表示为:
Cd+2NiO(OH)+2H2O  2Ni(OH)2+2Cd (OH)2已知Ni(OH)2和Cd (OH)2均难溶于水但能溶于酸,以下说法中正确的是
2Ni(OH)2+2Cd (OH)2已知Ni(OH)2和Cd (OH)2均难溶于水但能溶于酸,以下说法中正确的是
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
下列反应属于吸热反应的是
| A.氧化钙与水反应 | B.氢气在氧气中燃烧 |
| C.碳酸钙高温分解成氧化钙和二氧化碳 | D.氢氧化钾和硫酸中和 |
CO(g)与H2O(g)反应过程的能量变化如图所示,有关两者反应的说法正确的是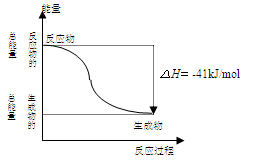
| A.该反应为吸热反应 |
| B.CO(g)与H2O(g)所具有的总能量大于CO2(g)与H2(g)所具有的总能量 |
| C.反应的热化学方程式是:CO(g) + H2O (g) = CO2(g) + H2(g);△H=+41kJ/mol |
| D.1mol CO2(g)和1mol H2(g)反应生成1molCO(g)1mol和H2O(g)要放出41kJ热量 |
X、Y、Z、R是1~18号元素中的四种元素,它们的原子结构有以下特点:①元素X原子的M层比L层少3个电子;②元素Y的2价阴离子的核外电子排布与氖原子相同;③元素Z原子的L层比M层多5个电子;④元素R原子的L层比K层多3个电子,其中金属性最强的是
| A.X | B.Y | C.Z | D.R |
下列说法中,正确的是
| A.构成原电池两个电极的材料必须是两种金属 |
| B.由铜,锌作电极与硫酸铜溶液组成的原电池中铜是正极 |
| C.铜锌原电池中电子由锌经外导线流向铜,再由铜经硫酸溶液流向锌 |
| D.铜锌原电池工作时,若有13g锌溶解,电路中有0.2mol电子通过 |