细心的学生发现化学中常见到五大常数,有阿伏加德罗常数(NA)、化学平衡常数(K)、电离平衡常数(K)、水的离子积常数(KW)、溶度积常数(Ksp),根据你所了解的化学知识判断下列叙述错误的是
| A.向仅含0.4mol FeI2的溶液中持续通入氯气,当有0.2 mol Fe2+被氧化时,转移电子的数目为0.6 NA |
| B.已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10。0.2mol·L-1HF溶液0.2mol·L-1CaCl2溶液等体积混合会有沉淀出现 |
| C.已知在T℃的温度下,水的离子积KW=1×10-10,0.01 mol/L的NaHSO4溶液与0.01 mol/L的NaOH溶液等体积混合,混合溶液pH为5,溶液显中性 |
| D.一个化学反应的平衡常数即与温度有关也与物质的计量数有关,化学平衡移动时,平衡常数不一定改变 |
离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,正确的是()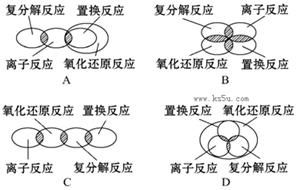
下列反应中,属于氧化还原反应的是()
| A.SO2+2KOH=K2SO3+H2O |
B.CaCO3 CaO+CO2↑ CaO+CO2↑ |
| C.Na2CO3+CaCl2=CaCO3↓+2NaCl |
| D.Fe+2FeCl3=3FeCl2 |
下列各组中的离子,能在溶液中大量共存的是()
| A.K+、H+、SO42-、OH- | B.Na+、K+、CO32-、NO3- |
| C.Na+、H+、Cl-、CO32- | D.K+、Cu2+、SO42-、OH- |
下列化学反应,能用离子方程式H++OH-=H2O表示的是()
| A.澄清石灰水与盐酸反应 | B.氢氧化钡溶液和稀硫酸反应 |
| C.氢氧化镁和稀硝酸反应 | D.氢氧化铁溶液与盐酸反应 |
下列两种物质的溶液混合后不能发生离子反应的是()
| A.HNO3和Na2CO3 | B.NaCl和AgNO3 |
| C.K2SO4和BaCl2 | D.HNO3和BaCl2 |