下面的实验仪器省去了固定装置,请根据要求回答问题: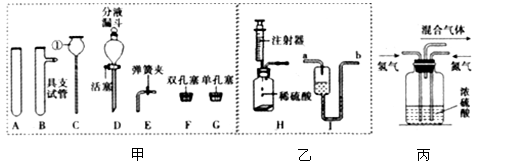
(1)图甲中仪器①的名称为____。
(2)图乙中的微型装置H可用于实验室制备CO2,此微型装置在操作上的优点是____;在图甲中可选择____(填序号)装配与装置H功能相同的装置,写出实验室制取二氧化碳的化学方程式:____。
(3)装配高锰酸钾制备氧气的发生装置,图甲中除固定装置外还缺的仪器是____(写名称);该反应的化学方程式为_______________________。
(4)用二氧化锰和过氧化氢溶液在微型装置H中制取氧气,其化学方程式为________;I是医用输液观察滴液快慢的滴壶,若用它做微型洗气装置,则气体应从____(填“a”或“b”)进入,其中所装洗气的液体不能装满的原因是________________________。
(5)氨气是一种无色、有刺激性气味、极易溶于水的气体,可用于制氮肥、硝酸、药物和染料等。工业上用氮气和氢气合成氨气(反应的化学方程式:N2+3H2 2NH3)。实验室模拟合成氨气的流程如下:
2NH3)。实验室模拟合成氨气的流程如下: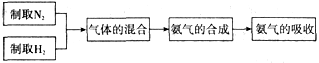
流程中“气体的混合”是在图丙装置中进行的,该装置的作用有三个:一是将氮气和氢气干燥;二是使氮气和氢气充分混合;三是____,从而提高氮气和氢气的利用率。
有一瓶用排水法收集好的无色气体,如图2-12所示方法进行暂时存放。据此,请你判断与这种气体相关的物理性质除颜色、状态外,还有:
_____________________________________;
_________________________________________。
图2-12
现有A、B、C、D四种物质。A是无色、无味的气体。B在A中燃烧发出明亮的蓝紫色火焰,同时生成一种无色有刺激性气味的气体C。D是一种无色的气体,把D通入澄清的石灰水中,石灰水变浑浊。试判断A、B、C、D各是什么物质,请将答案填在空格内。
A_________,B_________,C_________,D_________。
家庭养鱼用的鱼缸内,常放入一种送气装置,使用时会连续不断地冒出气泡,请你分析这套装置的作用是什么?__________________。它说明氧气具有哪些性质?__________________。
如图2-6所示,用带火星的木条分别以甲、乙两种方式迅速插入,观察到木条复燃,且在甲中燃烧比乙中燃烧更旺。上述实验说明氧气具有的性质是:
____________________________________;_________________________________________。
图2-6
有两瓶无色气体,它们分别是二氧化碳和氧气,有多种方法可将它们区别开来。请你模仿示例要求,列举两种鉴别方法:
举例:用带火星的木条分别插入瓶口下,复燃的是氧气,熄灭的是二氧化碳;
方法1:____________________________________;
方法2:____________________________________。