某同学对三种牙膏的成分和性质进行如下探究。
①测定牙膏的pH。
甲:pH=8.5 乙:pH=7.0 丙:pH=6.5能缓解牙齿酸痛的碱性牙膏是( 33)(填“甲”、“乙”、“丙”)。
②检验牙膏中是否含有碳酸钙。
该同学用检验碳酸盐的方法检验牙膏中是否含有碳酸钙,实验记录如下。
| 实验步骤 |
实验现象 |
实验结论 |
| 各取三种牙膏膏体于试管中,加入适量稀盐酸。 |
甲、乙牙膏的表面( 34);丙牙膏的表面无明显现象。 |
甲、乙牙膏中含碳酸钙,丙牙膏中不含碳酸钙。 |
上述实验不够完善,还需增加的一步操作是( 35) 。
③比较甲、乙牙膏中碳酸钙的质量分数。
【实验原理】通过测定逸出气体的质量,可计算出碳酸钙的质量分数(牙膏中其它物质不与盐酸反应)。
【实验步骤】按下图装置进行实验,记录不同时刻装置和药品的总质量,数据如下: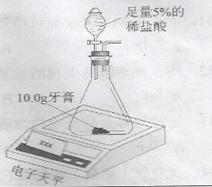
| 时间(min) |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
|
| 装置和药品总质量(g) |
牙膏甲 |
261.0 |
260.0 |
259.3 |
258.8 |
258.5[ |
258.5 |
258.5 |
| 牙膏乙 |
263.0 |
262.4 |
261.9 |
261.4 |
261.0 |
261.0 |
261.0 |
【实验结论】( 36);
【实验反思】经查实,上述方法所测得的两种牙膏的碳酸钙含量均偏小(实验操作规范),导致偏小的原因可能是( 37) 。
A.盐酸挥发 B.有水蒸气逸出
C.装置漏气 D.锥形瓶内残留二氧化碳
在实验探究课上,老师给同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种。同学们为了确定该粉末的成分,进行如下探究。请回答下列问题。
【提出问题】红色粉末的成分是什么?
【猜想假设】猜想l:红色粉末是铜粉;
猜想2:红色粉末是氧化铁粉;
猜想3:红色粉末是。
【设计方案】取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后高温至充分反应(实验装置如下图所示)。
请你完成下表:
| 实验中可能出现的现象 |
结论 |
| 红色粉末不变色,石灰水不变浑浊 |
猜想1成立 |
| 猜想2成立 |
|
| 猜想3成立 |
【实验结论】同学们进行了实验并经过分析,确认猜想3成立。
【反思评价】
(1)实验时通入一氧化碳片刻后再加热的原因是。
(2)从环保角度看,上述装置有不足之处,具体的改进措施是。
(3)请你用另一种反应原理证明猜想3成立,实验方案是。
化学小组根据氨气还原氧化铜的反应,设计实验测定Cu元素的相对原子质量。已知:① 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O② 氨气(NH3)是碱性气体
请结合下图回答问题。
(1)将纯净干燥的氨气通入B中,观察到玻璃管内黑色固体变为亮红色,管口有液滴,同时生成空气中含量最多的气体,写出B中发生反应的化学方程式为。
(2)测定Cu元素相对原子质量的实验过程为:先称量CuO的质量,完全反应后测定生成水的质量,由此计算出Cu元素的相对原子质量。
Ⅰ.小组同学利用上图进行实验,下列装置连接合理的是(填序号,装置可重复使用)。
① ACBDC② ADBCD③ ADBDC④ ABDC
Ⅱ.在本实验中,使测定结果偏大的原因可能是_______________ (填序号);
① CuO未完全起反应② CuO不干燥
③ CuO中混有不反应的杂质④ NH4C1与Ca(OH)2混合物不干燥
Ⅲ.在本实验中,还通过测定___________________________的质量达到实验目的。
假日里,同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
| 白色粉末的成分 |
形成的原因 |
| 可能是 |
石灰水与空气中CO2反应生成的沉淀 |
| 可能是 |
暑假气温较高,溶质的溶解度降低或溶剂蒸发, 石灰水中的溶质析出 |
经过反复思考,同学们认为白色粉末还可能是它们的混合物.
(2)设计实验:甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解,于是他得出粉末中一定有CaCO3的结论.乙同学查阅了溶解性表(如下图),认为甲同学的结论不严密,理由是: .
| OH- |
Cl- |
CO32- |
NO3- |
|
| Ca2+ |
微 |
溶 |
不 |
溶 |
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实验步骤 |
可能观察到的现象 |
结论 |
| 取上述试管中的上层清液, 滴加1~2滴无色酚酞试液 |
不变色 |
|
| 往上述试管内残留的固体中加入稀盐酸 |
白色粉末中有CaCO3 |
|
| 由上述实验可知白色粉末的成分是:。 |
化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
[提出问题1] 该氢氧化钠溶液是否变质了呢?
[实验探究1]
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 |
氢氧化钠溶液一定变质了。 |
[提出问题2] 该氢氧化钠溶液是全部变质还是部分变质呢?
[猜想与假设]
猜想1:氢氧化钠溶液部分变质。
猜想2:氢氧化钠溶液全部变质。
[查阅资料] 氯化钡溶液呈中性。
[实验探究2]
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钡溶液,并不断振荡。 |
有生成。 |
说明原溶液中一定有碳酸钠。 反应方程式 |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 |
溶液变红色。 |
说明原溶液中一定有 |
[实验结论] 该氢氧化钠溶液(填“部分”或“全部”)变质。
[反思与评价]
(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钡溶液,你认为该方案(填“可行”或“不可行”)。
[提出问题3]该溶液的变质程度如何呢?
实验步骤:取该溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,所加盐酸质量与产生气体质量关系如图:
试计算:
(1)m=g.
(2)原溶液中氢氧化钠的质量分数是多少?
某化学兴趣小组要对实验产生的废液进行研究。已知废液中可能含有硝酸钾、锰酸钾、氯化钡、氢氧化钠中的一种或几种。请根据以下实验回答问题。
(1)首先,观察废液为无色,则废液中一定不含什么物质?
(2)然后,测试废液的pH为13,则废液中一是含有什么物质?
(3)接下来,向废液中加入过量的稀硫酸,产生白色沉淀,则废液中一定还含有什么物质?可能含有什么物质?