(14分)某兴趣小组用图1所示流程制取氧气,并回收提纯氯化钾和二氧化锰
回答下列问题:
(1)请写出制取氧气的化学方程式 。在反应过程中,若收集到氧气3.2g时,其物质的量为 mol。在氯酸钾和二氧化锰混合物中,此时质量分数增加的物质是 ,当它的质量分数不在变化的实验判断依据是 。
(2)在回收提纯的过程中需要控制水的用量,原因有 (填标号)。
A.提高实验效率
B.保证固体1全部溶解
C.节约能源
(3)①写出图2中仪器a、b的名称:
a , 。
②步骤Ⅱ中的操作m应选择图2中 (填“甲”或“乙”)装置,该操作中玻璃棒的作用是 。
③步骤Ⅲ中用酸化的硝酸银(AgNO3)溶液检验洗出液中是否含有氯化钾,该检验方法的原理为 (用化学方程式表示)。
(4)实验结束后,称得回收到的氯化钾的质量比理论值小,可能的原因有 (写一点)。
(5)取少量烘干后二氧化锰放入盛有一定浓度过氧化氢溶液中,立刻有大量气泡产生,写出该反应的化学方程式 ,该反应属于 反应。此反应说明二氧化锰与氯酸钾混合加热后不变的是 。
几位同学根据下列各实验装置图,设计和讨论了以下问题: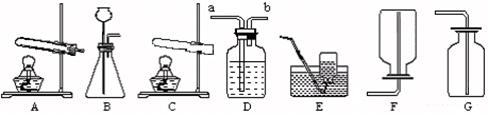
(1)实验室利用装置B可以制取CO2气体,反应方程式是;
(2)实验室利用装置A和E,可以制取并收集的气体是,该实验在气体收集满后,停止实验时,需要特别注意的操作是;如果利用装置D来收集气体,进气口应该是(填写装置中的“a”或“b”)。
(3)装置G可用来收集气体,该气体密度应比空气重,除此外,还应具备的性质是 .
金属在生产和生活中具有广泛的应用。(1)下列金属制品的用途中,利用金属导热性的是(填字母序号)。
A.铁锅 B.铜导线 C.铝箔
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁。赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为。
(3)铁制品容易锈蚀,铁生锈的条件是。
(4)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组利用废液制取海绵铜(Cu)和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)。请回答下列问题:
①溶液D中的溶质为;
②检验C过量的方法是;
③A~G七种物质中含铁元素的物质有(填字母序号)。
下图是甲、乙、丙三种固体的溶解度曲线,试回答: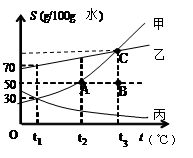
(1)t3℃时,甲、乙、丙三种物质溶解度的大小关系是。
(2)t3℃时,若将50g的甲、乙两种物质分别加入到100g水中,
充分溶解后,所得的溶液在溶解度曲线图中可表示为(“A”、“B”或“C”)点,若将甲溶液降温至t1℃,溶液的变化情况是。
I.溶液变为饱和 Ⅱ.溶解度增加 Ⅲ.溶质减少 Ⅳ.溶质的质量分数不变
江西龙虎上因特有的丹霞地貌被誉为“中国红石公园”,其红色砂砾岩由石灰岩、氢氧化铁、石膏等成分组成。请用恰当的化学用语表示下列带点部分:
(1)石灰岩中含有钙元素;(2)石膏主要成分硫酸钙中含有的阴离子;(3)岩石呈红色是含氢氧化铁所致,氢氧化铁中铁元素显+3价。
(8分)下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:
(1)写出图中编号仪器名称:a________、b_______
(2)利用上图所示装置,采用以下组合能完成实验室制取气体的是。
| A.用①③制取氧气 | B.用②⑤制取氧气 |
| C.用②④制取二氧化碳 | D.用②⑤制取氢气 |
(3)若实验室用氯酸钾在装置①中制氧气,其反应的化学方程式为 。
(4)小波同学将装置②进行了改进,如图Ⅰ和Ⅱ。改进后的装置与②装置相比,装置Ⅰ的优点是;装置Ⅱ的优点是;实验室若用装置Ⅰ制取二氧化碳,铜网上常放置的药品应为 。