下列图中的实验方案,能达到实验目的的是:
| |
A |
B |
C |
D |
| 实验 方案 |
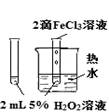 |
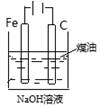 |
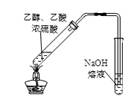 |
 |
| 实验 目的 |
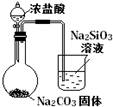
验证FeCl3对H2O2分解反应有催化作用 |
制备Fe(OH)2并能较长时间观察其颜色 |
实验室制取乙酸乙酯 |
比较HCl、H2CO3和H2SiO3的酸性强弱 |
在体积固定为2 L的密闭容器中,A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化情况如图所示。下列有关说法不正确的是( )
A.该反应的化学方程式为4A+5B 6C+4D
6C+4D
B.前2 min用B表示的反应速率约为0.002 1 mol·L-1·s-1
C.2 min时,外界条件的改变可能是升高温度或加入了催化剂
D.该反应为放热反应
在一定条件下的密闭容器中存在下列四个平衡体系,增大容器的体积对化学反应速率没有影响的是( )
A.2SO2+O2 2SO3 2SO3 |
B.CO+H2O(g) CO2+H2 CO2+H2 |
C.CO2(g)+H2O H2CO3 H2CO3 |
D.Fe3++3SCN- Fe(SCN)3 Fe(SCN)3 |
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1 |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7 |
| D.F点收集到的CO2的量最多 |
图甲、图乙分别表示反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )
CO(g)+H2O(g)ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )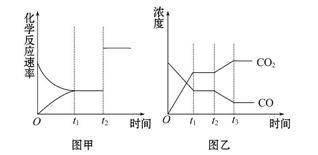
| A.图甲中t2时刻发生改变的条件是增大反应物的浓度 |
| B.图甲中t2时刻发生改变的条件可能是增大压强 |
| C.图乙中t2时刻发生改变的条件是升高温度 |
| D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气 |
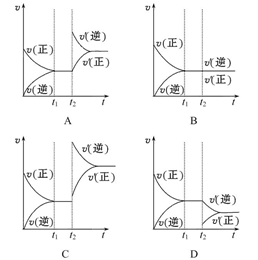
在密闭容器中,通入2 mol SO2和1 mol O2,发生反应2SO2+O2 2SO3,在t1时刻达到平衡。保持其他条件不变,在t2时刻,再通入一定量的SO3,下列有关反应速率(v)与时间(t)的关系曲线正确的是( )
2SO3,在t1时刻达到平衡。保持其他条件不变,在t2时刻,再通入一定量的SO3,下列有关反应速率(v)与时间(t)的关系曲线正确的是( )