氮元素的化合物应用十分广泛。请回答:
(1)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
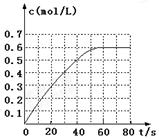
①298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时
③若反应在398K进行,某时刻测得n(NO2)="0.6" moln(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点。
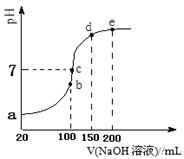
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH4+、Mg2+、CO32-、Ba2+、SO42-.将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 实验 序号 |
实验内容 |
实验结果 |
| 1 |
加AgNO3溶液 |
有白色沉淀生成 |
| 2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
| 3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是________.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 |
物质的量浓度(mol/L) |
(3)试确定K+是否存在?________,判断的理由是________________________________
某实验需要用1.0mol·L-1 NaOH 溶液450mL。
配制实验操作步骤有:a.在天平上称量g NaOH固体放入烧杯中,加水溶解,冷却至室温。b.把制得的溶液小心地注入中。c.继续向容器中加水至距刻度线1cm~2cm处,改用加水至刻度线。d.用少量水洗涤烧杯和玻璃棒2~3次。e.将瓶塞塞紧,充分摇匀。填写下列空白:
①操作步骤和正确顺序为。
②该配制过程中两次用到玻璃棒,其作用分别是、。
③在进行b步操作时,不慎有液体溅出,下列处理措施正确的是()
| A.继续进行实验 | B.添加部分NaOH溶液 |
| C.倒掉溶液,重新配制 | D.倒掉溶液,洗净容量瓶后重新配制 |
已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。
(1)步骤1的主要操作需用到的玻璃仪器除烧杯外有。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式),
固体残渣的成分是(填化学式)。
(3)步骤3中涉及的操作是:蒸发浓缩、、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是。
下列是关于药物华素片(西地碘片)使用说明书中的部分内容:
华素片(西地碘片)使用说明书
品名:华素片(西地碘片)
英文名:Cydiodine Tablets
成分:本品主要活性成分是分子碘,每片含量1.5mg。利用分
子分散技术将碘制成分子态西地碘,并含适量薄荷脑等。
[贮藏]:遮光、密闭、在阴凉处保存。
[有效期]:三年
(1)①华素片中含有的活性成分是_______(写分子式)
②请推断华素片______(“是”或“不是”)白色。
(2)某学生为验证华素片中含有上述活性成分,完成如下实验,请填写:
①取一粒药片放入研钵中研碎,再将药粉装入试管中,加入约2 mL蒸馏水;再向该试管中再加入约2mL_______(填选项字母),并用力振荡。
| A.酒精 | B.NaOH溶液 | C.四氯化碳 | D.盐酸 |
②描述加入该液体后可能观察到的现象________ ___ _______。
③选用该液体做实验的原因是__________。
粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:①加入稍过量的BaCl2 溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④过滤;⑤滴入稀盐酸至无气泡产生;
回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为
(2)如何运用最简单方法检验步骤①后溶液中有无SO42-离子?。如果有,应该如何除去SO42-离子?。
(3)步骤③加入稍过量Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是。
(4)将经过步骤④过滤操作后。请问这一操作能除掉哪些杂质?
。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,使用玻璃棒的目的:。